Znaczenie prognostyczne
Stężenie lipoproteiny (a) – Lp(a) koreluje liniowo i niezależnie od stężenia cholesterolu LDL z występowaniem:
1. Chorób sercowo-naczyniowych o podłożu miażdżycy
- miażdżycy tętnic wieńcowych, szyjnych i obwodowych
- zawału serca
- udaru niedokrwiennego mózgu
2. Zwężenia zastawki aortalnej
3. Niewydolności serca
4. Zgonu z przyczyn sercowo- naczyniowych
5. Zgonu z jakichkolwiek przyczyn
Wskazania do pomiaru lipoproteiny (a) – Lp(a)
Biorąc pod uwagę bezsprzeczne dowody na ścisłą zależność pomiędzy stężeniem Lp(a) w osoczu a występowaniem zdarzeń sercowo-naczyniowych, idealnie byłoby oznaczyć jej stężenie przynajmniej raz w życiu u wszystkich osób. Takie działanie pozwoliłoby na wyodrębnienie osób o wysokim ryzyku sercowo-naczyniowym i wdrożenie odpowiednich działań mających na celu poprawę rokowania odległego u pacjentów z podwyższonym stężeniem Lp (a) w osoczu. Natomiast oznaczenie stężenia Lp(a) zaleca się szczególnie w następujących sytuacjach klinicznych:
1. Osobista historia przedwczesnej choroby sercowo-naczyniowej (CVD).
2. Historia rodzinna przedwczesnych chorób sercowo-naczyniowych i/lub podwyższonych poziomów lipoproteiny (a) – Lp(a) – krewni I stopnia
3. U pacjentów z rodzinną hipercholesterolemią
4. W nawracających zdarzeniach CVD mimo leczenia statynami (progresja miażdżycy)
5. U pacjentów z opornością na statyny (<50%zmniejszenie stężenia LDL pomimo intensywnego leczenia
6. U pacjentów, u których potrzeba i/lub intensywność leczenia statynami nie jest jasna
7. Umiarkowane–bardzo wysokie ryzyko sercowo-naczyniowe oszacowane za pomocą algorytmów Systematic Coronary Risk Estimation 2 (SCORE2) i Systematic Coronary Risk Estimation 2-Older Persons (SCORE2-OP)
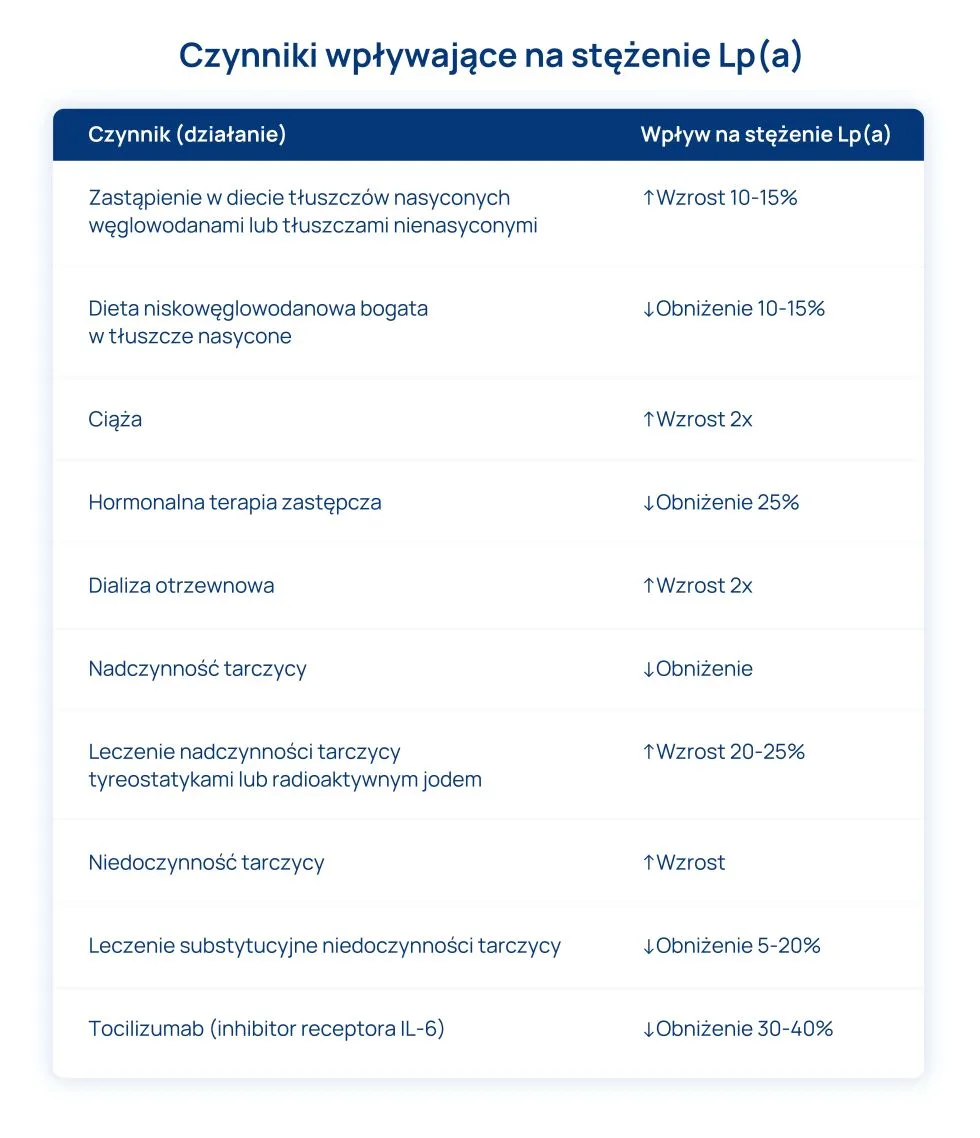
W Polsce nadal bardzo rzadko oznacza się stężenie lipoproteiny (a). Dzisiaj już wiemy, że jest to niezależny czynnik ryzyka sercowo-naczyniowego oraz że nawet 20-30% pacjentów z rodzinną hipercholesterolemią i/lub ostrym zespołem wieńcowym może mieć podwyższone stężenie Lp(a), powyżej 50 mg/dl często przy pożądanych stężeniach cholesterolu-LDL oraz że pojawiają się możliwości farmakologicznego zmniejszania stężenia Lp(a).
Zgodnie z rekomendacjami PTL/KLRWP/PTK/PTDL/PTD/PTNT Diagnostyki i leczenia zaburzeń lipidowych w Polsce 2021 stężenie Lp a) w osoczu/surowicy należy oznaczyć raz w życiu u każdej dorosłej osoby w celu wykrycia pacjentów ze zwiększonym jej stężeniem. Natomiast szczególnymi wskazaniami do oznaczenia stężenia Lp(a) są: przedwczesne wystąpienie choroby sercowo-naczyniowej, brak oczekiwanego efektu leczenia statyną, a także potrzeba lepszej stratyfikacji ryzyka u osób o granicznym ryzyku między umiarkowanym i dużym.

Obecnie nie ma leków, które skutecznie obniżałyby stężenie Lp(a) w osoczu. W związku z tym pacjentom z podwyższonym stężeniem Lp(a) zaleca się wczesną oraz bardzo intensywną modyfikację wszystkich innych czynników prowadzących do wzrostu ryzyka sercowo-naczyniowego. Pacjenci z wysokim stężeniem Lp(a) wymagają spersonalizowanego leczenia zaburzeń gospodarki lipidowej, nadciśnienia tętniczego oraz zaburzeń gospodarki węglowodanowej. Bardzo istotna jest ponadto szeroko pojęta modyfikacja stylu życia, szczególnie redukcja masy ciała, zwiększenie aktywności fizycznej, zaprzestanie palenia tytoniu.
Leczenie zaburzeń lipidowych powinno być kontynuowane zgodnie z obowiązującymi wytycznymi. Statyny pomimo udokumentowanego nieznacznego wpływu na podwyższenie stężenia lipoproteiny (a) – Lp(a) nie powinny być odstawiane, wręcz przeciwnie – leczenie musi być prowadzone intensywniej, niż wynikałoby to z poziomu ryzyka i stężenia cholesterolu LDL. Obniżenie stężenia cholesterolu LDL w tej grupie chorych wiąże się z poprawą rokowania sercowo-naczyniowego.
Nowsze grupy leków hipolipemizujących, jak inhibitory PCSK-9, obniżają stężenie lipoproteiny (a) w osoczu.
Bardzo skutecznym sposobem obniżenia stężenia Lp (a) jest afereza (obniżenia stężenia o 53-73% w porównaniu z wartością wyjściową). Tego typu leczenie przyczynia się do redukcji o 53-90% występowania zdarzeń sercowo-naczyniowych. Afereza Lp(a) jest zaaprobowanym sposobem postępowania np. w Niemczech i w Turcji u pacjentów ze stężeniem Lp(a) >60 mg/dl, u których pomimo leczenia maksymalnie tolerowanymi dawkami leków hipolipemizujących dochodzi do progresji miażdżycy. W polskich zaleceniach 6 towarzystw naukowych z 2021 r. autorzy podkreślili, że afereza Lp(a) wydaje się interesującą opcją leczenia u pacjentów z wysokim stężeniem Lp(a) i szybko postępującą miażdżycą.
W niedalekiej przyszłości mają być dostępne nowe grupy leków oparte na terapii antysensownej i interferencji mRNA.

Oznaczanie lipoproteiny (a) – Lp(a)
Stężenie Lp(a) oznacza się w osoczu/surowicy głównie przy pomocy metod immunochemicznych – immunoturbidymetrycznej, immunonefelometrycznej, różnych metod immunoenzymatycznych, w tym ELISA. Standaryzacja immunochemicznych metod oznaczania Lp(a) jest oparta na metrologicznej spójności kalibratorów z pierwotnym materiałem referencyjnym IFCC/WHO. Niestety nie uzyskano wystarczającej harmonizacji wyników uzyskiwanych różnymi metodami, co uznaje się za następstwo wpływu zmienności wielkości cząsteczki apo(a) na oznaczenia immunochemiczne Lp(a), mogącej prowadzić do zawyżania wyników w przypadku dużych i zaniżania w przypadku małych izoform. Dlatego też przy wielokrotnych oznaczeniach stężenia lipoproteiny (a) – Lp(a) należy posługiwać się tą samą metodą.
Przeczytaj też: Lipoproteina (a) – pomijany winowajca w leczeniu miażdżycy cz.1. Budowa i znaczenie
Piśmiennictwo
- Ferretti G, Bacchetti T, Johnston TP, et al.: Lipoprotein(a): A missingculprit in the management of athero-thrombosis?, J Cell Physiol. 2018
- Banach M, Penson PE.: Statins and Lp(a): do not make perfect theenemy of excellent, Eur Heart J. 2020; 41
- Tsimikas S.: A Test in Context: Lipoprotein(a) Diagnosis, Prognosis,Controversies, and Emerging Therapies, JACC. 2017,69
- Nordestgaard BG, Chapman MJ, Ray K, et al.: Lipoprotein(a) as a cardiovascular risk factor: current status. Eur Heart J. 2010, 31.
- Dominiczak MH, Caslake MJ.: Apolipoproteins: metabolic role and clinical biochemistry applications. Ann Clin Biochem. 2011 Nov,48, Epub 2011 Oct 25.
- Dąbrowski P, Prejbisz A.: Praktyka kliniczna – kardiologia. Czynniki ryzyka sercowo-naczyniowego w praktyce. Zwiększone stężenie lipoproteiny(a). Med. Prakt., 2023, 10.