Spis treści
- Na czym polega dieta low-FODMAP?
- Komu i kiedy rekomenduje się dietę low-FODMAP?
- Czy dieta low-FODMAP jest skuteczna i bezpieczna?
- Low-FODMAP czy inna dieta?
- Badanie z wykorzystaniem aplikacji mobilnej
- Podsumowanie
Zespół jelita drażliwego (ang. irritable bowel syndrome, IBS) to należąca do grupy zaburzeń interakcji jelitowo-mózgowych choroba, której towarzyszą nawracające bóle brzucha (mające związek z defekacją, zmianą rytmu wypróżnień lub konsystencją stolca). Większość pacjentów ze zdiagnozowanym zespołem jelita drażliwego (IBS) skarży się, że objawy nasilają się po spożyciu określonych produktów. Z tego względu rekomenduje się niekiedy czasowe wprowadzenie diety low-FODMAP. Na czym polega dieta low-FODMAP, komu jest zalecana, czy jest skuteczna oraz jaki ma wpływ na zespół jelita drażliwego (IBS) – o tym w poniższym artykule.
Na czym polega dieta low-FODMAP?
Dieta low-FODMAP (ang. fermentable oligosaccharides, disaccharides, monosaccharides and polyols) została opracowana przez naukowców z Monash University i zakłada ograniczenie spożycia żywności ulegającej szybkiej fermentacji w przewodzie pokarmowym, czyli oligosacharydów, disacharydów, monosacharydów i polioli. Do oligosacharydów zalicza się żywność bogatą we fruktany (np. pszenicę, cebulę, czosnek) i galaktooligosacharydy (np. rośliny strączkowe, niektóre orzechy), disacharydy obejmują żywność bogatą w laktozę (tj. mleko i produkty mleczne), do monosacharydów zalicza się żywność o dużej zawartości nadmiaru fruktozy (np. mango i miód), a poliole obejmują żywność bogatą w sorbitol (np. morela i awokado) lub mannitol (np. kalafior i grzyby). Wykazano, że związki te mogą nasilać objawy zespołu jelita drażliwego (IBS) poprzez nagromadzenie płynów w świetle jelita, przyśpieszenie motoryki jelit i nadmierną fermentację w jelicie grubym, co prowadzi do wzmożonego wydzielania gazów.
Dieta low-FODMAP składa się z 3 etapów. Etap pierwszy (eliminacji) trwa 4-8 tygodni i polega na wyeliminowaniu produktów o dużej zawartości FODMAP. Na etapie drugim (reintrodukcji), który trwa 6-10 tygodni powoli wprowadza się do diety w niewielkiej ilości wcześniej wyeliminowane produkty i sprawdza się reakcję organizmu. Etap trzeci (stabilizacji) to personalizacja diety na podstawie obserwacji i indywidualnej tolerancji pacjenta, czyli wykluczenie tych produktów z diety, które wywołały i/lub nasiliły objawy.
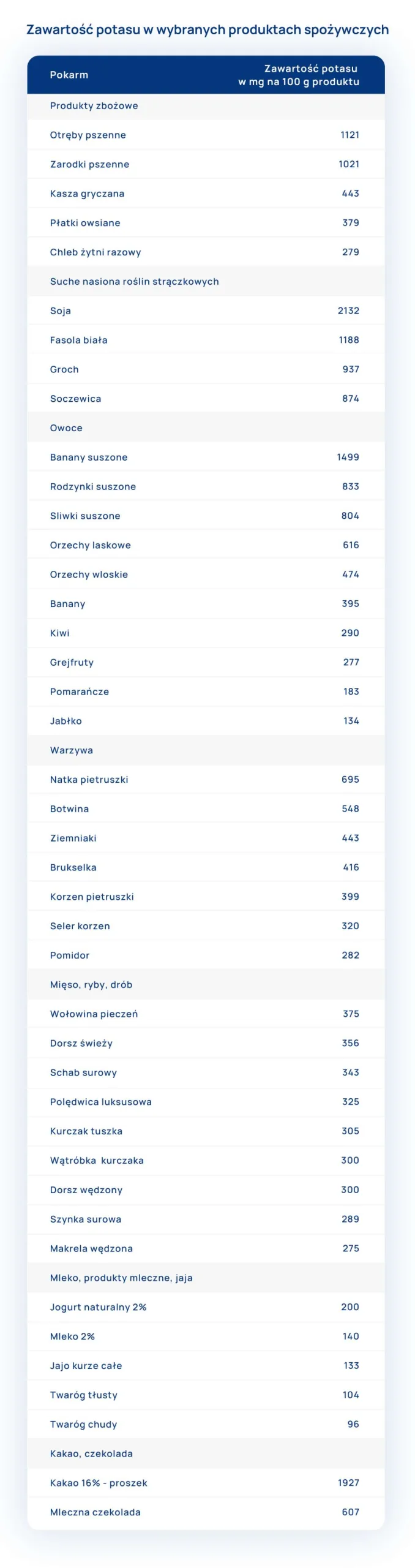
Podział produktów żywnościowych ze względu na zawartość FODMAP

Opracowanie na podstawie: Andrych K., Gładyś K., Zespół jelita nadwrażliwego – diagnostyka, rekomendacje, żywienie.
Komu i kiedy rekomenduje się dietę low-FODMAP?
Po wnikliwej ocenie klinicznej, rzetelne zebranym wywiadzie, badaniu przedmiotowym oraz wykonaniu ewentualnych badań laboratoryjnych lekarz może zalecić pacjentowi dietę low-FODMAP w celu zmniejszenia objawów spowodowanych chorobą. Oczywiście leczenie jest wieloczynnikowe i uzależnione od stopnia nasilenia objawów. Oprócz wdrożenia indywidualnych interwencji żywieniowych wpływ na wyniki leczenia ma również regularna i umiarkowana aktywność ruchowa oraz higiena snu. Niekiedy lekarz zaleci jednoczesne leczenie psychologiczne a w postaci umiarkowanej i ciężkiej również leczenie farmakologiczne, co szczegółowo zostało opisane w artykule Zespół jelita nadwrażliwego – objawy, diagnostyka, leczenie.
Czy dieta low-FODMAP jest skuteczna i bezpieczna?
Według dostępnych metaanaliz badań naukowych dieta low-FODMAP jest skuteczna w przypadku zespołu jelita drażliwego (IBS) i bezpieczna w krótkofalowym zastosowaniu. Nie jest ona jednak panceum dla wszystkich osób dotkniętych chorobą. Szacuje się, że przyczynia się do zmniejszenia lub eliminacji objawów u około 75% pacjentów ze zdiagnozowanym zespołem jelita drażliwego (zwłaszcza w postaci biegunkowej i mieszanej). Skuteczność diety upatruje się w ograniczeniu fermentacji, regulacji pasażu, zmniejszeniu objętości stolca i produkcji gazu. Należy jednak zaznaczyć, że nie rekomenduje się stosowania diety low-FODMAP bez wskazań lekarskich i na własną rękę. Pacjent powinien zostać poinstruowany przez lekarza lub poprowadzić ją pod okiem dietetyka klinicznego. Nieodpowiednio przeprowadzona lub zbyt długie jej stosowanie może prowadzić do m.in. niedoborów pokarmowych.
Low-FODMAP czy inna dieta?
W 2020 roku na łamach czasopisma Psychiatry Jouranal opublikowano badanie, w którym porównano m.in. wpływ różnych diet na zespół jelita drażliwego (IBS) w tym dietę low-FODMAP, bezglutenową i śródziemnomorską. Analiza trzech badań randomizowanych (w tym jedno z podwójnie ślepą próbą) wykazała wyraźną tendencję w kierunku poprawy konsystencji i częstotliwości wypróżnień po zastosowaniu diety low-FODMAP w porównaniu z pozostałymi dietami.
Badanie z wykorzystaniem aplikacji mobilnej
W lutym 2023 opublikowano największe badanie oceniające wpływ diety FODMAP na objawy zespołu jelita drażliwego (IBS) z wykorzystaniem aplikacji mobilnej FODMAP by FoodMaestro przez pacjentów.
Do badania zakwalifikowano 20 553 osób. Aplikacja zawiera kwestionariusz umożliwiający ocenę występujących u pacjentów następujących objawów: objawy ogólne, ból brzucha, wzdęcia, biegunkę i zaparcia, przy użyciu 4-punktowej skali Likerta (0 brak; 1 łagodne; 2 umiarkowane; 3 ciężki). U osób, u których występowały objawy na początku badania około połowa (45% – 55%) zgłosiła zmniejszenie objawów na pierwszym etapie diety FODMAP, szczególnie bólu brzucha, wzdęć, biegunki i zaparć.
Do 2 etapu zakwalifikowano się już tylko 2053 uczestników. Poziom tolerancji na poszczególne produkty oceniano za pomocą pytania pojawiającego się na ekranie pod koniec każdego dnia: „Czy na podstawie objawów możesz przejść do kolejnego kroku?” Jeśli uczestnicy odpowiedzieli „nie”, produkt spożywczy został oznaczony jako nietolerowany, a jeśli „tak”, produkt uznano za tolerowany. Najczęściej zgłaszanymi objawami podczas prowokacji pokarmowych były objawy ogólne, ból brzucha i wzdęcia. Najbardziej problematycznymi produktami okazały się chleb pszenny (13,1%), cebula (10,1%), czosnek (8%), mleko (7,8%) oraz makaron pszenny (6,3%).
Etap drugi diety ukończyło 965 uczestników i zostali oni zakwalifikowani do etapu trzeciego. Podczas personalizacji diety aplikacja wykluczyła produkty, które spowodowały objawy na etapie drugim lub które pacjenci zaznaczyli ręcznie. Świadomość ta umożliwiła im wyeliminowanie produktów, na które organizm źle reagował lub produktów nielubianych.
Podsumowanie
Dieta low-FODMAP jest skuteczna w przypadku zespołu jelita drażliwego (IBS) i bezpieczna w krótkim czasie. Jest ona dietą niedoborową i nie powinna być stosowana bez wcześniejszej przeprowadzonej diagnostyki i bez zaleceń lekarskich. Szacuje się, że prawidłowo przeprowadzona przyczynia się do zmniejszenia lub eliminacji objawów u około 75% pacjentów poprzez ograniczenie fermentacji, regulację pasażu jelitowego, zmniejszenie objętości stolca i produkcji gazu. Dieta jest etapowa i dość wymagająca pod kątem uważności, ale przejście przez nią znacznie poprawia komfort życia, pozwalając ustalić, które z produktów wywołują i/lub nasilają niepożądane objawy.
Piśmiennictwo
- Dimidi E, et al. Gut Symptoms during FODMAP Restriction and Symptom Response to Food Challenges during FODMAP Reintroduction: A Real-World Evaluation in 21,462 Participants Using a Mobile Application. Nutrients. 2023; 15(12):2683.
- Manning LP, Yao CK, Biesiekierski JR. Therapy of IBS: Is a Low FODMAP Diet the Answer? Front Psychiatry. 2020 Aug 31;11:865. doi: 10.3389/fpsyt.2020.00865. PMID: 33110411; PMCID: PMC7488954.
- Mearin F, et al., Bowel Disorders. Gastroenterology. 2016 Feb 18:S0016-5085(16)00222-5. doi: 10.1053/j.gastro.2016.02.031. Epub ahead of print. PMID: 27144627.
- Pietrzak A., i in., Rekomendacje diagnostyczno-terapeutyczne w zespole jelita nadwrażliwego. Gastroenterology Review 2018; 13 (4). Wytyczne-IBS-pol-2018.pdf (ptg-e.org.pl)