Artykuł został zaktualizowany 19.09.2025 r.
Atopowe zapalenie skóry to przewlekła, nawrotowa i niezwykle uciążliwa choroba zapalna skóry, charakteryzująca się silnym świądem oraz typowymi zmianami wypryskowymi. Stanowi ona poważne wyzwanie zarówno dla pacjentów, jak i dla lekarzy, znacząco obniżając jakość życia chorych i ich rodzin. Jak rozpoznać AZS? Skąd w ogóle bierze się ta choroba? Czy jest możliwe skuteczne leczenie? Chcesz dowiedzieć się, jak poradzić sobie z AZS? Jeśli tak, to poniższe słowa są skierowane właśnie do Ciebie.
Spis treści:
- AZS – co to jest atopowe zapalenie skóry?
- Przyczyny AZS
- Jak często występuje atopowe zapalenie skóry?
- Jak wygląda atopowe zapalenie skóry? Objawy
- Diagnostyka atopowego zapalenia skóry – jakie badania należy wykonać?
- Jak leczyć atopowe zapalenie skóry?
- Czy AZS da się całkowicie wyleczyć?
- Atopowe zapalenie skóry – często zadawane pytania
AZS – co to jest atopowe zapalenie skóry?
Atopowe zapalenie skóry jest jedną z najczęstszych chorób dermatologicznych. Zalicza się do grupy tzw. schorzeń atopowych, do której należą również astma oskrzelowa, alergiczny nieżyt nosa i alergiczne zapalenie spojówek.
Kluczowym objawem jest uporczywy i intensywny świąd, prowadzący do błędnego koła „świąd–drapanie–zmiany skórne”, co dodatkowo uszkadza ten narząd i zaostrza stan zapalny.
Choroba ma charakter przewlekły, z okresami zaostrzeń i remisji, a jej przebieg zmienia się wraz z wiekiem pacjenta.
Przyczyny AZS
Podłoże AZS jest wieloczynnikowe i nie do końca jeszcze poznane. Uważa się, że do rozwoju choroby niezbędne jest współwystępowanie kilku elementów:
- czynniki genetyczne; najlepiej udokumentowanymi genetycznymi przyczynami są mutacje w genie filagryny, dodatkowo posiadanie bliskich krewnych z AZS istotnie zwiększa ryzyko zachorowania,
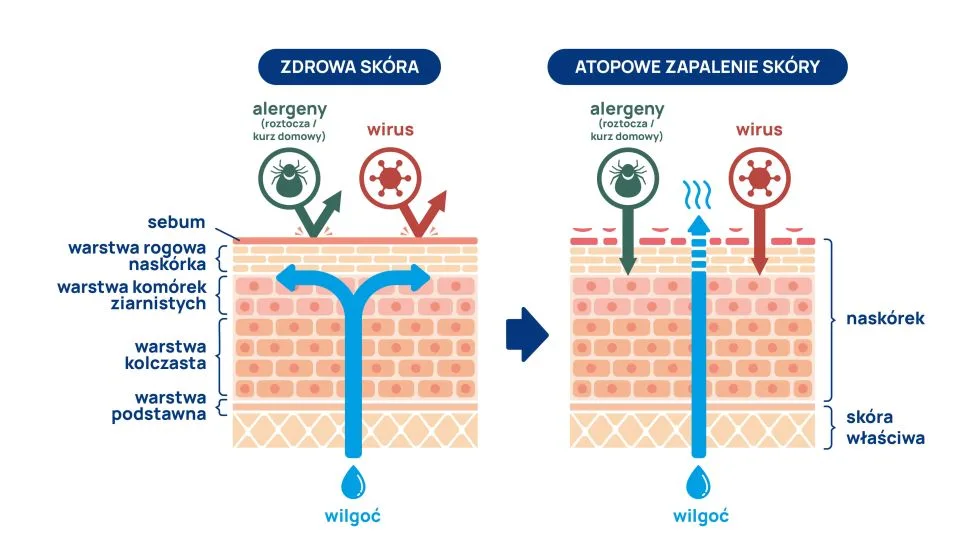
- dysfunkcja bariery skórnej; uszkodzona, „nieszczelna” bariera skórna to główny punkt patogenezy,
- nadreaktywność układu immunologicznego; przez uszkodzoną barierę skórną dostają się czynniki pobudzające komórki układu odpornościowego do aktywności, stąd bierze się stan zapalny oraz – prawdopodobnie – sprzyja to powstawaniu różnych alergii,
- czynniki środowiskowe; alergeny (wziewne, pokarmowe, kontaktowe), drażniące substancje chemiczne (detergenty, mydła, konserwanty), zanieczyszczenie powietrza, klimat (niska wilgotność, ekstremalne temperatury), a także stres psychiczny i infekcje skórne (głównie gronkowcem złocistym Staphylococcus aureus) mogą WTÓRNIE (słowo klucz!) zaostrzać zmiany.
Jak często występuje atopowe zapalenie skóry?
W naszym kręgu cywilizacyjnym atopowe zapalenie skóry występuje u około 10-30% dzieci i 2-10% dorosłych. W ostatnich dziesięcioleciach jej częstość wzrosła aż 2-3 krotnie, najnowsze dane wskazują jednak na pewne plateau co do zachorowań.
AZS może ujawnić się w każdym wieku, jednak u większości chorych (około 60%) pojawia się w pierwszym roku życia, a u 85-90% przed ukończeniem 5. roku życia.
U części dzieci choroba ustępuje samoistnie z wiekiem, ale u znaczącego odsetka utrzymuje się w wieku dorosłym lub nawraca.
Jak wygląda atopowe zapalenie skóry? Objawy
Obraz kliniczny AZS jest zróżnicowany i zależy w dużej mierze od wieku pacjenta, jednak stałym i najważniejszym objawem jest silny świąd.
Początkowe objawy AZS
Zależne są od wieku pacjenta; w różnych podgrupach początkowo choroba manifestuje się nieco inaczej. Jak wspomniano, choroba najczęściej pojawia się w wieku niemowlęcym, gdzie pierwsze zmiany pojawiają się na twarzy (policzki, czoło, owłosiona skóra głowy) oraz na prostownikach kończyn. Są to rumieniowe, wysiękowe, sączące się ogniska, często z obecnością grudek i nadżerek. Świąd manifestuje się rozdrażnieniem dziecka, płaczliwością i problemami ze snem.
Objawy AZS w okresie niemowlęcym
Okres niemowlęcy i wczesnodziecięcy charakteryzuje się występowaniem ostrych, sączących zmian wypryskowych na twarzy, tułowiu oraz powierzchniach wyprostnych kończyn, a także w zgięciach (okolice nadgarstków, pod kolanami, pod pachami, w dołach łokciowych). Skóra jest wyraźnie sucha, łuszcząca się.
Objawy AZS w okresie dzieciństwa
U dzieci powyżej 2. roku życia zmiany stają się bardziej suche, grudkowo-złuszczające i przestają sączyć. Typowa lokalizacja to zgięcia stawowe (pod kolanami, w zgięciach łokciowych), nadgarstki, kostki, szyja oraz grzbiety rąk i stóp.
Jeśli choroba nie jest leczona to z czasem dochodzi do tzw. lichenizacji, czyli pogrubienia skóry, uwydatnienia jej naturalnego rysunku (tzw. skóra jakby „ubita młotkiem”) i przebarwień.
>> Przeczytaj też: Atopowe zapalenie skóry u dzieci (AZS). Diagnostyka i leczenie
Objawy AZS w okresie młodzieńczym
U młodzieży i dorosłych zmiany mają charakter przewlekły z dominującą lichenizacją. Są zlokalizowane głównie na zgięciach stawowych, twarzy (w tym powiekach), szyi, dekolcie oraz grzbietach rąk i stop. Skóra jest bardzo sucha, szorstka i pogrubiała. Częstym problemem jest nawracające zapalenie czerwieni wargowej (cheilitis) oraz zapalenie spojówek i powiek.
Diagnostyka atopowego zapalenia skóry – jakie badania należy wykonać?
Rozpoznanie AZS stawiane jest klinicznie, na podstawie wywiadu i charakterystycznych objawów. Nie istnieje jedno badanie laboratoryjne, które potwierdzałoby chorobę. Lekarz (dermatolog lub alergolog) posługuje się ustalonymi kryteriami diagnostycznymi.
Najczęściej stosowanymi kryteriami diagnostycznymi są te zaproponowane przez Hanifina i Rajkę, które obejmują 5 głównych cech klinicznych, takich jak świąd, przewlekły i nawracający przebieg, typowa lokalizacja zmian skórnych, atopia w wywiadzie oraz początek choroby przed 2. rokiem życia. Badania służą głównie ocenie stanu zapalnego, identyfikacji potencjalnych alergenów zaostrzających oraz diagnostyce różnicowej.
Przydatne mogą być:
- badania laboratoryjne: oznaczenie swoistych IgE (asIgE) w surowicy (tzw. testy alergiczne z krwi), mogą pomóc w identyfikacji alergenów wziewnych lub pokarmowych; morfologia krwi z rozmazem może wykazać podwyższoną eozynofilię,
- testy skórne: są przydatne w wykrywaniu IgE-zależnej alergii na alergeny wziewne i pokarmowe, wynik należy zawsze korelować z objawami klinicznymi,
- testy płatkowe (naskórkowe): mają zastosowanie w diagnostyce kontaktowego alergicznego zapalenia skóry, które często współwystępuje z AZS, utrudniając jego leczenie,
- w niejasnych przypadkach może być konieczna biopsja skóry w celu wykluczenia innych schorzeń, takich jak łuszczyca, świerzbiączka, łojotokowe zapalenie skóry czy chłoniaki skóry.
Jak leczyć atopowe zapalenie skóry?
Leczenie AZS to nic innego jak opanowanie świądu, zmniejszenie stanu zapalnego, naprawa bariery skórnej i zapobieganie zaostrzeniom:
- podstawowa terapia to emolienty stosowane codziennie i przez cały czas, niezależnie od stanu zaawansowania choroby; nawilżają i regenerują uszkodzoną barierę naskórkową, zmniejszają świąd, powinny być aplikowane kilka razy dziennie,
| UWAGA nr 1 Emolient emolientowi nierówny; preparaty nazywające się dumnie “emolientami” czasami nimi nie są. Zapytaj swojego lekarza, co stosować – unikniesz preparatów, które przez nieodpowiedzialność producenta pogorszą stan Twojej skóry. |
- leczenie przeciwzapalne miejscowe:
- glikokortykosteroidy miejscowe: „złoty standard” w leczeniu zaostrzeń, stosuje się je krótkotrwale, z zachowaniem zasad bezpieczeństwa (m.in. przerwy w leczeniu), aby uniknąć działań niepożądanych,
- inhibitory kalcyneuryny: leki immunomodulujące, niebędące sterydami, są szczególnie przydatne w leczeniu delikatnych obszarów (twarz, powieki, szyja),
| UWAGA nr 2 Istnieje tzw. terapia proaktywna, która polega na stosowaniu obu grup wymienionych wyżej preparatów 2 razy w tygodniu na miejsca podatne na nawroty w celu utrzymania remisji. To bardzo cenne postępowanie – zdecydowanie godne polecenia! |
- leczenie ogólnoustrojowe: stosowane w przypadku ciężkich, opornych na leczenie miejscowych postaci AZS,
- fototerapia: naświetlania promieniami UVA lub UVB są skuteczną, lecz rzadko stosowaną metodą leczenia dla młodzieży i dorosłych,
- leki biologiczne: zarezerwowane dla pacjentów z ciężką postacią choroby, pacjent pozostaje wtedy pod opieką ośrodka klinicznego.
- leczenie objawowe: leki przeciwhistaminowe II i I generacji w celu zmniejszenia świądu i poprawy snu, antybiotyki w przypadku wtórnych nadkażeń bakteryjnych.
Czy AZS da się całkowicie wyleczyć?
Obecnie AZS jest uważane za chorobę nieuleczalną w sensie trwałego i całkowitego pozbycia się predyspozycji do jej rozwoju. Ma charakter przewlekły i nawrotowy. Jednak, dzięki nowoczesnym i skutecznym metodom leczenia, możliwe jest osiągnięcie stanu całkowitego lub prawie całkowitego braku objawów.
Celem terapii jest pełna kontrola nad chorobą, umożliwiająca pacjentowi normalne funkcjonowanie zawodowe, społeczne i rodzinne bez uciążliwych dolegliwości. U większości dzieci AZS ustępuje samoistnie z wiekiem.
Atopowe zapalenie skóry – często zadawane pytania
Morfologia krwi nie służy do rozpoznania AZS, może jednak wykazać pewne nieprawidłowości często towarzyszące stanowi zapalnemu, takie jak podwyższony poziom eozynofilii (eozynofilia).
Czynniki zaostrzające to m.in.: stres, alergeny (roztocza, pyłki, sierść zwierząt, niektóre pokarmy), drażniące substancje chemiczne (detergenty, chlor, twarda woda), suche powietrze (klimatyzacja, sezon grzewczy), nagłe zmiany temperatury, pot, niektóre tkaniny (wełna, sztuczne tworzywa), infekcje bakteryjne i wirusowe.
AZS często współwystępuje z chorobami z kręgu autoimmunologii, takimi jak bielactwo nabyte, alopecia areata (łysienie plackowate) czy choroby autoimmunologiczne tarczycy (Hashimoto, Gravesa-Basedowa).
U pacjentów z AZS często obserwuje się niedobór witaminy D, której prawidłowy poziom jest istotny dla prawidłowego funkcjonowania bariery skórnej i modulacji odpowiedzi immunologicznej. Mogą również występować niedobory nienasyconych kwasów tłuszczowych, cynku oraz witaminy E. Suplementację zawsze należy konsultować z lekarzem.
Nieleczone lub źle kontrolowane AZS prowadzi do utrwalonych zmian skórnych, wtórnych infekcji bakteryjnych (gronkowiec), wirusowych (mięczak zakaźny, opryszczka) i grzybiczych. Powoduje wyniszczający, przewlekły świąd, bezsenność, stany lękowe, depresję, izolację społeczną i znaczące obniżenie jakości życia.
Piśmiennictwo
- Girolomoni G, Busà VM. Flare management in atopic dermatitis: from definition to treatment. Therapeutic Advances in Chronic Disease. 2022;13.
https://journals.sagepub.com/doi/full/10.1177/20406223211066728?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org - American Academy of Pediatrics, Treatment of Atopic Dermatitis
https://www.aap.org/en/patient-care/atopic-dermatitis/treatment-of-atopic-dermatitis/ - Eichenfield LF, Stripling S, Fung S, Cha A, O’Brien A, Schachner LA. Recent Developments and Advances in Atopic Dermatitis: A Focus on Epidemiology, Pathophysiology, and Treatment in the Pediatric Setting. Paediatr Drugs. 2022 Jul;24(4):293-305. doi: 10.1007/s40272-022-00499-x. Epub 2022 Jun 13. PMID: 35698002; PMCID: PMC9191759.
https://pmc.ncbi.nlm.nih.gov/articles/PMC9191759/ - Lyons JJ, Milner JD, Stone KD. Atopic dermatitis in children: clinical features, pathophysiology, and treatment. Immunol Allergy Clin North Am. 2015 Feb;35(1):161-83. doi: 10.1016/j.iac.2014.09.008. Epub 2014 Nov 21. PMID: 25459583; PMCID: PMC4254569.
https://pmc.ncbi.nlm.nih.gov/articles/PMC4254569/ - Jeskey J, Kurien C, Blunk H, Sehmi K, Areti S, Nguyen D, Hostoffer R. Atopic Dermatitis: A Review of Diagnosis and Treatment. J Pediatr Pharmacol Ther. 2024 Dec;29(6):587-603. doi: 10.5863/1551-6776-29.6.587. Epub 2024 Dec 9. PMID: 39659858; PMCID: PMC11627575.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11627575/