Nadnercza to gruczoł parzysty, będący częścią układu hormonalnego. Jak sama nazwa wskazuje położne są nad górnymi biegunami nerek. W artykule opisujemy anatomię nadnerczy i ich funkcje. Odpowiadamy na pytanie jakie hormony wydzielają nadnercza i czy rzeczywiście istnieje coś takiego jak wypalenie nadnerczy.
Spis treści
- Nadnercza – co to za struktura i gdzie są nadnercza?
- Nadnercza – budowa i histologia. Kora nadnerczy i rdzeń nadnerczy
- Hormony nadnerczy – jakie hormony produkują nadnercza? Funkcje nadnerczy
- Nadnercza – objawy chorób nadnerczy
- Badania nadnerczy
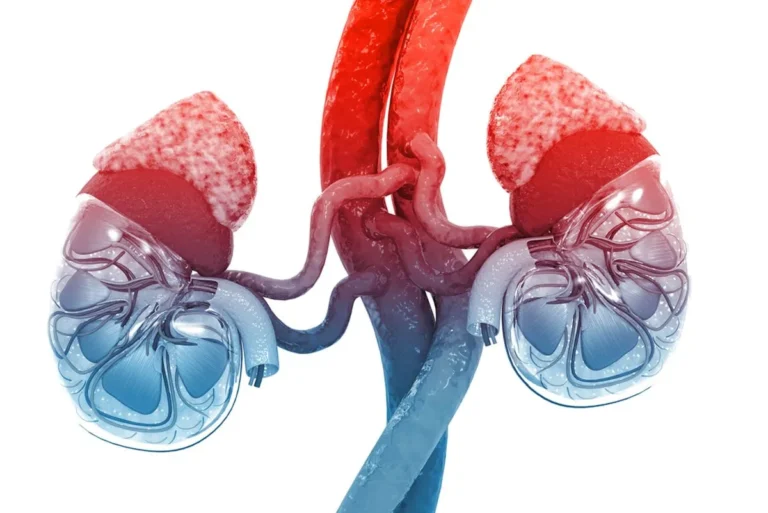
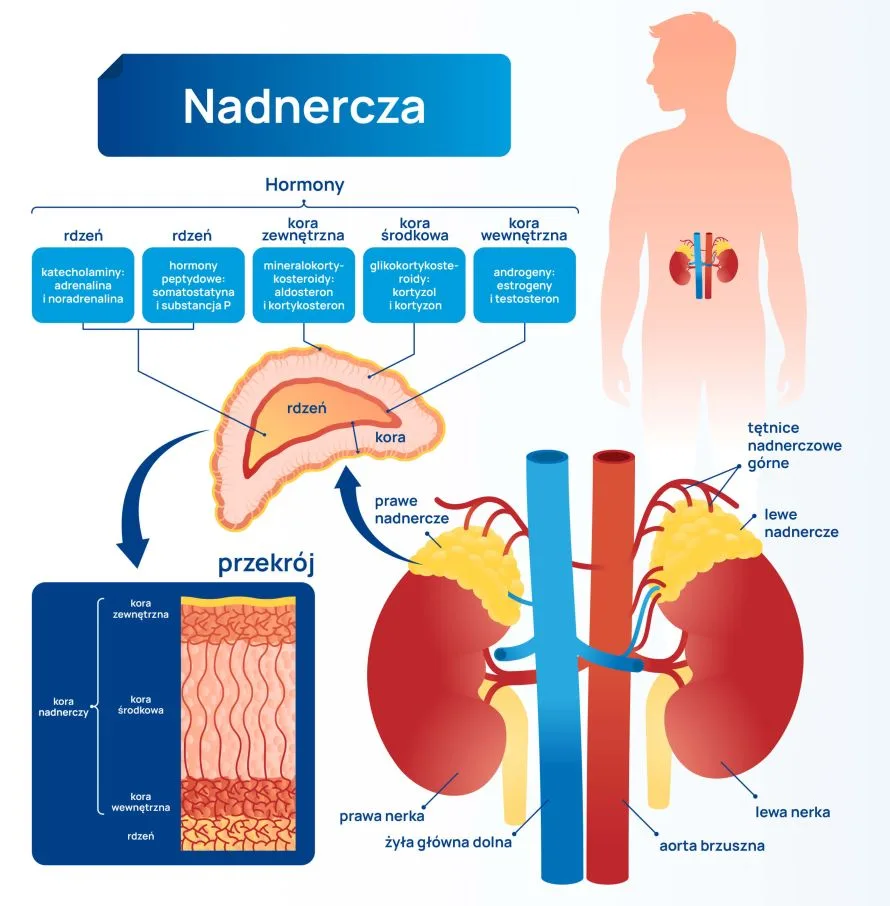
Nadnercza – co to za struktura i gdzie są nadnercza? Anatomia nadnerczy
Co to są nadnercza? Są to dwa symetryczne, leżące zaotrzewnowo gruczoły, wydzielające szereg ważnych dla funkcjonowania człowieka hormonów. Umiejscowione są ponad górnymi biegunami nerek, w tylnej części brzucha. Lokalizacja nadnerczy i ich położenie względem innych narządów jamy brzusznej powoduje, że u zdrowego, dorosłego człowieka mogą być niewidoczne w badaniu USG.
Nadnercza to bardzo małe gruczoły, mające 3-5 cm długości, 3 cm szerokości i 0,4-1 cm grubości. Ich masa u człowieka dorosłego to zaledwie kilka – kilkanaście gramów (5-10 g, nie przekracza 18 g), stanowi 0,01% masy całego ciała. Ciekawe jest to, że nadnercza u zarodka bardzo szybko się powiększają i pod koniec 2 miesiąca u płodu są większe niż nerka. Powiększanie wymiarów trwa przez całą ciążę, do zakończenia III trymestru, chociaż tempo przyrostu w następnych po I trymestrze jest wolniejsze. Nadnercza u noworodka to ok. 30% wielkości nerek. Ich masa w wieku okołoporodowym osiąga wagę 5-10 g, czyli taką jak u dorosłego. Po urodzeniu nadnercza nadal ulegają przebudowie i jest to proces trwający aż do 15.r.ż, kiedy ustala się ich ostateczna struktura.
Kolejne zmiany w morfologii nadnerczy obserwowane są u osób starszych, u których zmniejsza się masa części narządu i zmienia jego struktura, co może wpływać na wydolność tych gruczołów.
Anatomia nadnerczy
Pomimo że nadnercza są narządem symetrycznym, nie są identyczne. Prawe nadnercze jest trójkątne, leży za prawym płatem wątroby i przed przeponą. Jest mniejsze niż nadnercze lewe, które ma kształt półksiężyca i leży nieznacznie wyżej niż gruczoł z prawej strony. Gruczoł z lewej strony sąsiaduje z żołądkiem.
Nadnercza otoczone są torebką włóknistą, pod którą leży warstwa kory nadnerczy. Dzięki zawartości tłuszczów kora nadnerczy ma kolor żółty. Pod warstwą kory znajduje się rdzeń nadnerczy.
Nadnercza to gruczoły o bogatym unaczynieniu. Obficie reprezentowane są również naczynia limfatyczne, odprowadzające chłonkę do obszaru lędźwiowych węzłów chłonnych.
Pacjenci często zastanawiają się, czy nadnercze boli lub, czy nadnercza bolą. Unerwienie nadnerczy to liczne gałązki odchodzące do splotu słonecznego (splotu trzewnego) tworzące splot nadnerczowy. Kora nadnerczy jest unerwiona dosyć słabo, otrzymuje niewielką część włókien współczulnych, w większości nerwy ze splotu nadnerczowego dochodzą do wnętrza gruczołu, czyli rdzenia nadnerczy.
>>> Przeczytaj też: Kortyzol – hormon stresu
Nadnercza – budowa i histologia. Kora nadnerczy i rdzeń nadnerczy
Nadnercza składają się z dwóch warstw:
- kory – wydzielającej hormony steroidowe,
- rdzenia – który wydziela katecholaminy.
Kora nadnercza – budowa
Budowa histologiczna nadnerczy w części korowej to:
- warstwa kłębkowata – najcieńsza i leżąca bezpośrednio pod torebką. W tej warstwie wytwarzany jest aldosteron, dzięki znajdującej się tam syntazie aldosteronu i CYP11B2,
- warstwa pasmowata kory nadnerczy – najgrubsza, to tutaj produkowany jest kortyzol, hormony androgenowe i niewielka część estrogenów. Kortyzol z warstwy pasmowatej powstaje pod wpływem nagłej stymulacji układu hormonalnego,
- warstwa siatkowata – leżąca najgłębiej, zawiera szerokie zatokowe naczynia włosowate. W tej warstwie również syntetyzowany jest kortyzol, jednak, w przeciwieństwie do strefy pasmowatej, jego produkcja w tej części kory nadnerczy to odpowiedź na stymulację przedłużoną w czasie.
Grubość i masa kory nadnerczy zmniejsza się z wiekiem. Zmieniają się też proporcje między warstwą pasmowatą, która nie zanika, a nawet może nieco zwiększyć objętość, a warstwą siatkowatą, która staje się coraz cieńsza, a jej komórki rozproszone. Zanika też granica między nimi. W skrajnych przypadkach komórki warstwy siatkowatej tworzą rozproszone, słabo odgraniczone skupiska wśród komórek wytwarzających glikokortykosteroidy, głównie kortyzol.
Rdzeń nadnercza
Warstwa rdzeniowa nadnerczy zajmuje centralne położenie w tym gruczole, zbudowana jest z beleczek nabłonka. Biegną w nich naczynia krwionośne i nerwy. W cytoplazmie tych komórek występują ziarenka zawierające określony hormon.
>>> Przeczytaj też: Jak zbadać poziom kortyzolu? Badanie kortyzolu z krwi, śliny i moczu – różnice
Hormony nadnerczy – jakie hormony produkują nadnercza? Funkcje nadnerczy
Nadnercza odgrywają bardzo istotną rolę w organizmie, ponieważ hormony, które wydzielają, umożliwiają reakcję na stres zarówno fizyczny, jak i psychiczny.
| WAŻNE! Nadnercza są niezbędne dla życia. Bez nadnerczy człowiek nie może przeżyć. |
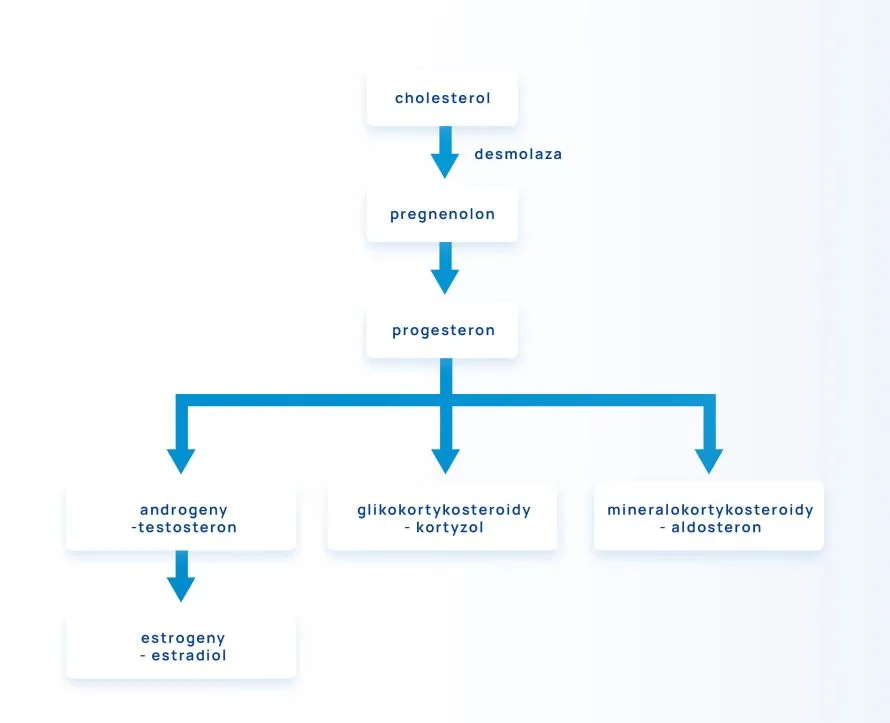
Hormony kory nadnerczy to trzy główne grupy hormonów, z których każda ma swoje funkcje. Są to:
- glikokortykosteroidy – są to hormony steroidowe, należy do nich kortyzol. Wytwarzane są z cholesterolu poprzez szereg reakcji w mitochondriach oraz gładkiej siateczce endoplazmatycznej. Cholesterol, który jest pozyskiwany z diety lub syntetyzowany w komórkach, przechowywany jest w cytoplazmie komórek syntetyzujących steroidy.
- mineralokortykosteroidy – np. aldosteron. Mineralokortykosteroidy pomagają w utrzymaniu jonowej równowagi osocza, są konieczne do utrzymania prawidłowych stężeń sodu i potasu, oraz prawidłowej objętości płynów pozakomórkowych. Zwiększają ciśnienie tętnicze krwi, pobudzając swoiste receptory w ośrodkowym układzie nerwowym.
- androgeny – są hormonami kontrolującymi rozwój płciowy, odpowiadają za libido i potencję. Głównymi androgenami są androstendion i dehydroepiandrosteron (DHEA/DHEA-S). Androgeny wydzielane przez nadnercza mają słabe działanie biologiczne, dlatego poza nadnerczami przekształcane są do bardziej aktywnych hormonów, np. testosteronu. Aż 40-60% puli testosteronu u kobiet pochodzi z konwersji DHEA, która odbywa się w nadnerczach i jajnikach. U mężczyzn z DHEA powstaje 5% puli testosteronu, nie ma to więc znaczenia klinicznego. To, w jakim kierunku metabolizowany jest dehydroepiandrosteron, zależy przede wszystkim od tkanki docelowej i aktywności enzymów katalizujących w niej te przemiany, a nie od płci.
Hormony rdzenia nadnerczy to katecholaminy. Są to:
- adrenalina – stanowi 80% amin katecholowych uwalnianych z rdzenia. Synteza i magazynowanie adrenaliny ma miejsce właśnie w rdzeniu nadnerczy, jej uwalnianie do krążenia odbywa się przede wszystkim pod wpływem stresu.
- noradrenalina – to substancja, która wytwarzana jest nie tylko w nadnerczach, ale również we włóknach układu współczulnego. Syntetyzowana z aminokwasu tyrozyny, w odpowiedzi na kortyzol uwalniany z kory nadnerczy podlega konwersji do adrenaliny.
- dopamina – w nadnerczach wytwarzana jest w niewielkich ilościach. Główne miejsce jej wytwarzania to ośrodkowy układ nerwowy, gdzie pełni funkcję neuroprzekaźnika.
Nadnercza – objawy chorób nadnerczy
Objawy chorób nadnerczy pojawiają się, gdy wytwarzają one za dużo lub za mało hormonów, czyli gdy pojawia się nadczynność lub niedoczynność tego gruczołu.
W zależności tego, którego hormonu dotyczą zaburzenia i czy występują u kobiet, czy u mężczyzn objawy mogą być zróżnicowane.
Objawy chorób nadnerczy mogą występować w przebiegu:
- zespołu Cushinga lub choroby Cushinga – związane z zaburzeniami sekrecji kortyzolu,
- zespół Conna – spowodowanego guzem wydzielającym aldosteron,
- choroba Addisona – niedobór kortyzolu i aldosteronu.

Niedoczynność kory nadnerczy – objawy
Charakterystyczne objawy niedoczynności kory nadnerczy to:
- ciemnienie skóry szczególnie w miejscach narażonych na działanie promieni słonecznych lub ucisk,
- brunatne przebarwienia kości, linii zgięć na dłoniach i grzbiecie rąk, otoczek brodawek sutkowych, blizn.
Niecharakterystyczne objawy niedoczynności kory nadnerczy to:
- osłabienie, zmniejszona tolerancja wysiłku fizycznego,
- utrata łaknienia,
- nudności, wymioty,
- luźne stolce,
- ból mięśni i stawów,
- zasłabnięcia (wskutek hipotensji ortostatycznej lub hipoglikemii).
Nadczynność kory nadnerczy – objawy
Objawy nadczynności kory nadnerczy to:
- otyłość centralna, z gromadzeniem się tłuszczu na twarzy, karku i w dołkach nadobojczykowych,
- zaczerwienienie twarzy i dekoltu,
- zaniki mięśni obręczy barkowej i miednicznej,
- sinoczerwone rozstępy skóry brzucha, pośladków, czasami kończyn,
- kruchość naczyń – łatwe powstawania siniaków,
- sucha, cienka, pergaminowa skóra – łatwo ulega uszkodzeniom mechanicznym, rany goją się niezwykle trudno,
- zmiany grzybicze (szczególnie często łupież pstry) i ropne (czyraki),
- upośledzona odporność (mogą rozwijać bardzo ciężkie zakażenia bakteryjne i wirusowe oraz uogólnione zakażenia grzybicze),
- liczne zaburzenia metaboliczne, w tym insulinooporność, skłonność do hiperglikemii, nietolerancja glukozy, cukrzyca t. 2, zaburzenia poziomu cholesterolu
- skłonność do hipokaliemii (obniżone stężenie potasu),
- osłabienie wytrzymałości kości i możliwość złamań patologicznych,
- hiperkalciuria – zwiększa ryzyko kamicy nerkowej,
- wzrost ciśnienia śródgałkowego i zaćma,
- zaburzenia pamięci i funkcji poznawczych,
- bezsenność,
- zaburzenia miesiączkowania lub wtórny brak miesiączki u kobiet, objawy androgenizacji,
- zaburzenia erekcji u mężczyzn,
- obniżenie libido u obu płci.
Zmęczenie nadnerczy i wypalenie nadnerczy
Zmęczone lub wypalone nadnercza to termin funkcjonujący w intrenecie oraz mediach społecznościowych. Często używany jest przez zwolenników medycyny alternatywnej i sprzedawców suplementów. Warto podkreślić, iż badania klinicznie nie potwierdzają istnienia takiej choroby ani stanu klinicznego.
Liczne opisywane objawy zmęczenia nadnerczy np. osłabienie, zmęczenie, wyczerpanie, problemy ze snem, zaburzenia koncentracji, zaburzenia odporności, problemy z masą ciała, itp. są dosyć powszechne w dzisiejszym społeczeństwie, mogą być „zasługą” stylu życia i świadczyć o gorszej kondycji organizmu. Jednak przypisywanie tych wszystkich dolegliwości „zmęczeniu nadnerczy” i „leczenie” wypalenia nadnerczy suplementami diety nie jest postępowaniem, które przyniesie korzyści. Powyższe symptomy mogą być pochodną np. choroby tarczycy, depresji, niedokrwistości, ich przyczyną może być wiele innych schorzeń. Dlatego w przypadku występowania takich objawów należy zrobić badania diagnostyczne i – po ewentualnym wykluczeniu przyczyn – skoncentrować się na poprawie diety, higienie snu i odpowiedniej aktywności fizycznej.
Warto wspomnieć, iż sytuacja przypominająca „wypalenie nadnerczy” może mieć miejsce w wieku starszym, gdy na skutek przebudowy tkanek w tych gruczołach mogą występować problemy z ich poprawnym funkcjonowaniem. Mówimy jednak wówczas o niedoczynności kory nadnerczy, której pierwszym i często jedynym objawem może być hipotonia ortostatyczna, brana mylnie za skutek starzenia się układu naczyniowego (miażdżyca, zmniejszenie wrażliwości baroreceptorów) lub działania leków (np. hipotensyjnych, agonistów dopaminy).
Niedoczynność nadnerczy u osób starszych:
- niedoczynność kory nadnerczy może latami przebiegać pod postacią zespołu przewlekłego zmęczenia, bólów mięśni i stawów oraz utraty apetytu – powszechnych dolegliwości starszych ludzi.
- w warunkach zmniejszonej rezerwy nadnerczowej w podeszłym wieku zaostrzenie jakiejkolwiek choroby przewlekłej może doprowadzić do przełomu nadnerczowego, niezwykle ważne więc jest wczesne rozpoznanie choroby.
- starsi ludzie we wstrząsie lub innym stanie ostrym znajdują się w grupie ryzyka wystąpienia czynnościowej (odwracalnej) niewydolności kory nadnerczy.
- oceniając badania laboratoryjne u osoby starszej, należy – niezależnie od przyczyny zlecenia tych badań – zwrócić uwagę na stężenia elektrolitów w surowicy. Hiponatremia, częsta u starszych pacjentów, wymaga uwzględnienia w diagnostyce różnicowej niedoczynności kory nadnerczy.
>>> Przeczytaj też: Hiponatremia i hipernatremia – objawy, przyczyny, diagnostyka i leczenie
Badania nadnerczy
Badanie nadnerczy i diagnostyka chorób nadnerczy obejmuje badania laboratoryjne hormonów syntetyzowanych w nadnerczach oraz diagnostykę obrazową. W badaniach nadnerczy wykorzystuje się także testy czynnościowe, które oceniają reakcję i wydzielanie poszczególnych hormonów nadnerczy w odpowiedzi na podanie różnych leków.
Podstawowe badania nadnerczy to oznaczenie poziomu kortyzolu i ACTH – hormonu przysadki mózgowej, który reguluje czynność nadnerczy, wykorzystywane w diagnostyce choroby Addisona i Cushinga.
Aldosteron to hormon wykorzystywany w diagnostyce zespołu Conna.
Badanie stężenia adrenaliny i noradrenaliny są pomocne w rozpoznawaniu guzów nadnerczy.

Badania obrazowe nadnerczy to tomografia komputerowa, rezonans magnetyczny lub scyntygrafia. W badaniu USG nadnercza nie zawsze są widoczne.
Podsumowanie
Nadnercza to niewielkie gruczoły, bez których człowiek nie jest w stanie przeżyć. Ich domeną jest stwarzanie warunków dla organizmu do odpowiadania na stres i mobilizowanie do działania. Nie ma specjalnego sposobu dbania o te gruczoły. Tak jak cały organizm lubią zdrowe odżywianie, aktywność fizyczną. Lubią również, jeśli umiemy radzić sobie ze stresem.
>>> Przeczytaj też: Gruczolak nadnercza: objawy, przyczyny, badania i leczenie
Piśmiennictwo
- https://www.czytelniamedyczna.pl/4603,morfologiczne-i-czynnociowe-obrazowanie-nadnerczy.html
- https://www.mp.pl/podrecznik/pediatria/chapter/B42.1.4.1.1.
- Gray H. Anatomy of the Human Body. https://www.bartleby.com/lit-hub/anatomy-of-the-human-body/1f-the-chromaphil-and-cortical-systems/#6, dostęp 01.04.2025
- https://podyplomie.pl/wiedza/wielka-interna/1312,podstawowe-wiadomosci-o-korze-nadnerczy
- https://podyplomie.pl/wiedza/wielka-interna/1250,proces-starzenia-a-czynnosc-kory-nadnerczy
- Cadegiani F.A., Kater C.E.: Adrenal fatigue does not exist: a systematic review. BMC Endocr Disord. 2016 Aug 24;16(1):48. doi: 10.1186/s12902-016-0128-4.
- Hormone Health Network.”Adrenal Fatigue | Hormone Health Network.” Hormone.org, Endocrine Society, 20 August 2019, https://www.hormone.org/diseases-and-conditions/adrenal-fatigue
- Bochenek A., Reicher M., Anatomia Człowieka, tom V, PZWL Warszawa 1989, s. 288.
- Diagnostyka laboratoryjna z elementami biochemii klinicznej, pod red. A. Dembińskiej-Kieć, J. Naskalskiego i B. Solnicy, wyd. IV, Wrocław 2018, s. 571-581.