Starzenie się organizmu jest nieuchronnym procesem, który w pewnym okresie życia dotyczy każdego. Wraz z wiekiem komórki ludzkiego ciała ulegają powolnej, coraz słabszej regeneracji, narządy wewnętrzne stopniowo wyczerpują swoje funkcje. W ośrodkowym układzie nerwowym tworzy się coraz mniej połączeń nerwowych, a kolejne neurony obumierają. Fizjologicznie dochodzi do tego około 60-65 roku życia. Co dzieje się w sytuacji, gdy zaburzenia pamięci pojawiają się nagle i zaczynają utrudniać codziennie funkcjonowanie? Czy problem z rozpoznawaniem osób bliskich, miejsc i dat jest naturalnym procesem starzenia? A może to jednak otępienie starcze?
Spis treści:
- Otępienie – definicja
- Demencja: przyczyny występowania otępienia starczego
- Objawy charakterystyczne dla otępienia
- Postępowanie diagnostyczne procesu otępiennego
- Leczenie procesów otępiennych
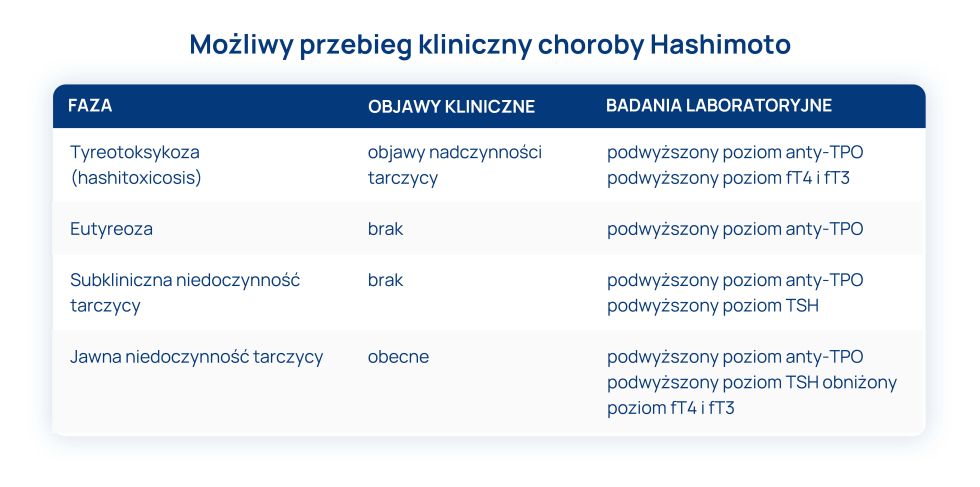
Otępienie – definicja
Demencja (otępienie) to proces postępującego obniżania się sprawności intelektualnej człowieka, wywołany uszkodzeniem mózgu. Poziom zaawansowania deficytów poznawczych jest na tyle głęboki, że zaburza codziennie funkcjonowanie chorego i powoduje konieczność pozostawania zależnym od opiekuna.
Zgodnie z kryteriami przyjętymi przez Światową Organizację Zdrowia (ang. World Health Organization, WHO), otępienie jest zespołem wywołanym chorobą mózgu o charakterze przewlekłym lub postępującym, w którym występuje zaburzenie funkcji poznawczych: myślenia, pamięci, orientacji, rozumienia, liczenia, zdolności uczenia się, porównywania, oceniania i dokonywania wyborów. Nie dochodzi w tym procesie do zaburzeń świadomości.
>> Sprawdź: Badania laboratoryjne dla seniorów
Demencja a łagodne zaburzenia funkcji poznawczych
Każdy proces otępienny może być poprzedzony, na wiele lat przed wystąpieniem pełni objawów, stanem nazywanym łagodnymi zaburzeniami funkcji poznawczych. Najbardziej charakterystyczne dla tego stanu jest to, że mimo odczuwania przez pacjenta pogorszenia w zakresie pamięci, orientacji, rozumienia czy funkcji językowych, pozostaje on samodzielny, bez zaburzeń w zakresie codziennego funkcjonowania i nie wykazuje cech otępienia.
Upośledzenie funkcji poznawczych często poprzedzone jest przez obniżenie kontroli nad reakcjami emocjonalnymi, społecznymi, motywacją czy zachowaniem.

Demencja: przyczyny występowania otępienia starczego
Otępienie nie jest naturalnie postępującym procesem starzenia się ośrodkowego układu nerwowego. W trakcie rozwoju choroby dochodzi w różnym tempie do pogarszania się poszczególnych funkcji poznawczych, o których wspomnieliśmy we wcześniejszym fragmencie artykułu.
Wraz z procesem otępiennym chorym towarzyszy spadek kontroli nad emocjami (chwiejność emocjonalna), pogarszająca się zdolność do panowania nad reakcjami społecznymi, zachowaniem, motywacją.
Schorzenie ma charakter postępujący, przewlekły. W zależności od czynnika sprawczego (przyczyny), może rozwijać się powoli lub dynamicznie, pogarszając funkcjonowanie chorego w ciągu kilku tygodni do kilku miesięcy. Najważniejszymi przyczynami prowadzącymi do uszkodzenia układu nerwowego są choroby neurodegeneracyjne jak:
- choroba Alzheimera (Alzheimer Disease – AD),
- otępienie z ciałkami Lewy’ego (Dementia with Lewy Bodies – DLB),
- otępienie czołowo-skroniowe (Frontotemporal Dementia – FTD),
a także choroby zakaźne, metaboliczne i naczyniowe mózgu. Bardzo często w diagnostyce procesu demencyjnego spotykać się można z mieszanymi typami procesu otępiennego.
W przypadku dziedzicznych i rodzinnych przyczyn rozwoju procesu otępiennego, dokładny mechanizm uszkodzenia OUN jest zróżnicowany.
Procentowy udział poszczególnych przyczyn wywołujących proces otępienny OUN przestawia się następująco:
- choroba Alzheimera – 47%;
- otępienie naczyniowe – 28%;
- otępienie czołowo-korowe – około 7%;
- otępienie z ciałkami Lewego – około 5%;
- pozostałe typy – około 13%.
Podejmując się diagnostyki otępienia, w ramach różnicowania demencji z innymi jednostkami chorobowymi, bierze się pod uwagę m.in.: łagodne zaburzenia funkcji poznawczych, zaburzenia depresyjne, majaczenie.
>> To może Cię zainteresować: Choroba Alzheimera: wczesne sygnały ostrzegawcze dla pacjenta
Otępienie naczyniopochodne
W przypadku, gdy otępienie postępuje na wskutek procesu chorobowego rozwijającego się w naczyniach, mówi się o tzw. otępieniu naczyniopochodnym (będącym następstwem cukrzycy, miażdżycy, nadciśnienia tętniczego czy przebytego udaru OUN). Przyczyną wystąpienia otępienia naczyniopochodnego do mózgu dociera mniejsza ilość tlenu i substancji odżywczych. Prowadzi to do postępującego uszkodzenia komórek nerwowych (neuronów).
Otępienie jako efekt zmian zwyrodnieniowych OUN
W procesie demencyjnym, powstałym jako efekt zmian zwyrodnieniowych OUN, dochodzi do niszczenia komórek nerwowych poprzez odkładanie się w neuronach nieprawidłowych białek.
W przypadku dziedzicznych i rodzinnych przyczyn rozwoju procesu otępiennego, dokładny mechanizm uszkodzenia OUN jest zróżnicowany.
>> Przeczytaj też: Sarkopenia – przyczyny, objawy, diagnostyka, leczenie
Objawy charakterystyczne dla otępienia
Z uwagi na początkowy bezobjawowy lub skąpoobjawowy przebieg procesu otępiennego, rozpoznanie pierwszych symptomów choroby bywa utrudnione. Objawy często są na tyle dyskretne, że bywają niezauważalne przez samego chorego.
Wśród najczęstszych problemów pacjentów wyróżnia się:
- zaburzenia pamięci świeżej (zapominanie, jaką wykonuje się czynność, a także o umówionych wcześniej wizytach; mylenie godzin konsultacji lekarskich/spotkań; chowanie i gubienie przyborów osobistych);
- zapominanie i gubienie słów, gorsze przyswajanie nowych treści i przekazywanych informacji; trudności ze skupieniem uwagi;
- narastająca utrata zainteresowań, apatia;
- trudność z rozpoznawaniem osób bliskich lub poszukiwanie nieżyjących już krewnych albo znanych wcześniej miejsc (w tym np. gubienie drogi do domu);
- utrudnione dobieranie słów, problemy z pisaniem i liczeniem;
- zaburzenia zachowania i chwiejność emocjonalna (impulsywnośc, nadmierna nerwowość, obniżenie nastroju);
- stopniowe wycofywanie się z życia społecznego;
- szybkie zniechęcenie, rozdrażneinie, skłonność do płaczu;
- ograniczenie funkcji motorycznych i samodzielnego wykonywania czynności domowych (ubierania i rozbierania się, sprzątania, mycia, gotowania).
Wraz z pogłębieniem się demencji, chorzy coraz bardziej zaczynają być zależni od otoczenia i wymagają coraz większego wsparcia najbliższych.
>> Sprawdź również: Kryptopiroluria – choroba, która nie istnieje
Postępowanie diagnostyczne procesu otępiennego
Możliwość wystąpienia demencji wzrasta wraz z wiekiem chorego (powyżej 50 roku życia). Statystycznie schorzenie to rozpoznawane jest u 1% populacji w wieku 60-65 lat, a u około w 10-35% u osób powyżej 85. roku życia. Szacuje się, że około pół miliona populacji Polski mierzy się z diagnozą otępienia, z czego prawie 50% stanowi choroba Alzheimera.
Podstawą do postawienia rozpoznania jest wywiad zebrany od chorego i jego rodziny, opiekunów.
W diagnostyce wykorzystuje się szereg różnych testów psychologicznych i przesiewowych umożliwiających rozpoznanie zaburzeń funkcji poznawczych jak:
- krótka skala oceny stanu umysłowego (Mini Mental State Examination, w skr. MMSE),
- monteralska skala oceny zaburzeń funkcji poznawczych (MoCa test),
- test rysowania zegara,
- Całościowa Ocena Geriatryczna (COG),
- skala Depresji Becka,
- Kwestionariusz Zdrowia Pacjenta- PHQ-9.
By wykluczyć przyczyny metaboliczne występujących dolegliwości, niezbędne jest poszerzenie diagnostyki o badania laboratoryjne takie jak:morfologia krwi obwodowej z rozmazem, ferrytyna, TSH, fT4, glukoza, stężenie elektrolitów (sód, potas), poziom witaminy B12, kwasu foliowego, profil lipidowy, proteinogram.

Każdy chory, u którego z czasem pogłębiają się zaburzenia funkcji poznawczych, powinien być poddany badaniom diagnostyki obrazowej – np. rezonansowi magnetycznemu czy tomografii komputerowej ośrodkowego układu nerwowego. Cennym uzupełnieniem badań jest badanie neuropsychologiczne, konsultacja z zakresu neurologii, psychiatrii czy geriatrii.
Leczenie procesów otępiennych
W zależności od typu rozpoznanego procesu otępiennego, chory poddawany jest odpowiedniemu leczeniu.
- W przypadku otępienia o typie naczyniopochodnym nie ma tak naprawdę żadnej skutecznej metody terapeutycznej. Leczenie polega na łagodzeniu niektórych objawów i spowolnieniu procesu demencyjnego poprzez prawidłowe leczenie chorób będących przyczyną niedokrwienia, jak cukrzyca, nadciśnienie tętnicze, migotanie przedsionków czy zaburzenia lipidowe. Należy więc zadbać o właściwe odżywianie, ustabilizowanie wartości ciśnienia tętniczego krwi, poziomu cholesterolu i glukozy we krwi, by zapobiec dalszemu uszkodzeniu OUN.
- W leczeniu otępienia alzheimerowskiego, w zależności od stopnia zaawansowania choroby, stosuje się różne preparaty z uwzględnieniem takich substancji jak inhibitory cholinoesterazy (donepezil, riwastigmina, galantamina). Zastosowanie tych preparatów ma na celu poprawę przekaźnictwa nerwowego w układzie cholinergicznym poprzez zwiększenie stężenia acetylocholiny w mózgu. Drugą grupą leków są preparaty prokognitywne jak np. memantyna.
Sam proces farmakoterapii ma służyć przede wszystkim spowolnieniu rozwoju procesu otępiennego i podtrzymaniu całościowego funkcjonowania osoby chorej.

Demencja: znaczenie diety w leczeniu otępienia starczego
Poza standardową farmakoterapią mającą na celu poprawę sprawności umysłowej czy modyfikującej zachowanie chorego (leki uspokajające, przeciwdepresyjne), niezwykle istotne jest leczenie żywieniowe. Zaleca się, by dieta osoby z rozpoznaniem procesu otępiennego była urozmaicana w szereg substancji odżywczych.
W diecie wskazane jest stosowanie:
- kwasów tłuszczowych omega-3 (kwasy EPA, DHA), które poprawiają przekaźnictwo nerwowe, a kwasy DHA odgrywają rolę w prewencji odkładania złogów ϐ-amyloidu w OUN (udowodniono, że dieta bogata w ryby zmniejsza o 60% ryzyko rozwoju choroby Alzheimera);
- witamin A, E, C (podaż witaminy E zawartej w naturalnych produktach żywnościowych jest bardziej skuteczna niż w postaci suplementów diety);
- polifenoli roślinnych;
- witamin z grupy B: B6, B12, i kwasu foliowego (niedobory tych witamin, a głównie kwasu foliowego, sprzyjają zwiększeniu stężenia homocysteiny we krwi co stanowi dość istotny prognostycznie czynnik rozwoju m.in. choroby Alzheimera).
>> To może Cię zainteresować: Jak łączyć witaminy i minerały? Synergizm i antagonizm składników odżywczych
Objawy otępienia pojawiają się często po wielu latach postępującego procesu uszkadzającego ośrodkowy układ nerwowy. Każdy niepokojący objaw, mogący wskazywać na rozwój demencji, powinien wzbudzić czujność zarówno samych chorych, jak i ich rodzin czy pracowników ochrony zdrowia, którzy na co dzień mają z nimi styczność. Im wcześniej choroba zostanie rozpoznana, tym więcej możliwości terapeutycznych będzie można zaproponować pacjentowi, a tym samym podnieść komfort i jakość jego dalszego życia.
Bibliografia
- „Medycyna rodzinna. Podręcznik dla lekarzy i studentów”. A. Windak, S. Chlabicz, A. Mastalerz- Migas, wyd. Termedia , Poznań 2015
- dostęp online w dniu 23.11.2024r. : https://www.mp.pl/pacjent/dieta/diety/diety_w_chorobach/194938,dieta-w-chorobie-alzheimera
- dostęp online w dniu 23.11.2024 r.: https://www.mp.pl/pacjent/neurologia/choroby/150100,otepienie
- „Rzadkie i nietypowe otępienia”. Susham Gupta, Olivia Fiertag, James Warner, Advances in psychiatric treatment (2009), vol. 15, 364–371
- „Geriatria z elementami gerontologii ogólnej. Podręcznik dla lekarzy i studentów”. T. Grodzicki, J. Kocemba, A. Skalska, wyd. Via Medica, Gdańsk 2006