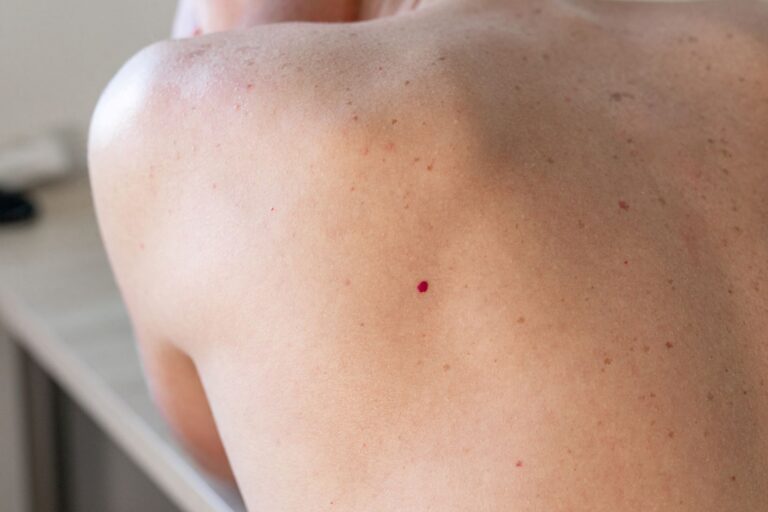
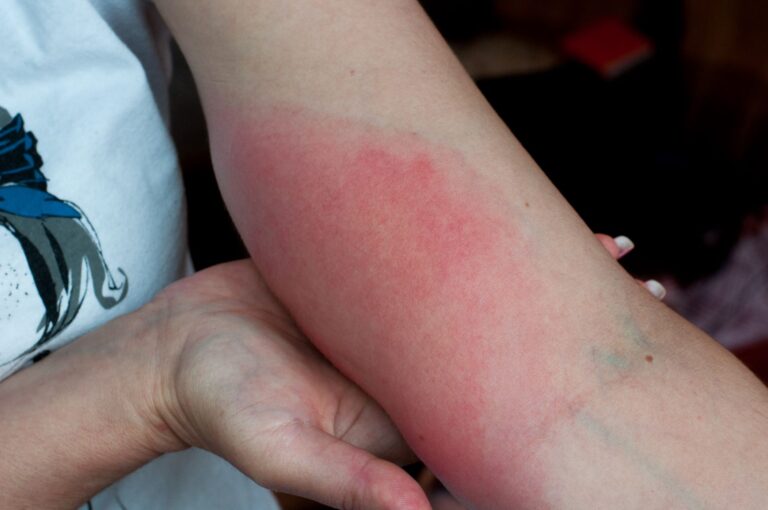
Punkty rubinowe, znane również jako naczyniaki starcze lub naczyniaki rubinowe, to częsty powód niepokoju pacjentów zgłaszających się do dermatologa. Choć w większości przypadków są zmianami łagodnymi i nie wymagają leczenia, ich nagłe pojawienie się, zwiększająca się liczba lub nietypowa lokalizacja mogą budzić uzasadnione wątpliwości diagnostyczne.
W niniejszym artykule przyglądamy się naczyniakom rubinowym z perspektywy klinicznej i dermatopatologicznej. Omawiamy mechanizmy ich powstawania, najczęstsze lokalizacje, różnicowanie z innymi zmianami skórnymi oraz dostępne metody diagnostyczne i terapeutyczne.
Spis treści:
- Czerwone kropki na ciele jak pieprzyki. Czym są punkty rubinowe?
- Naczyniaki rubinowe: przyczyny rozwoju rubinków na ciele
- Czy punkty rubinowe są niebezpieczne dla zdrowia?
- Kiedy iść do lekarza z rubinkami na skórze?
- Jak można usunąć czerwone „pieprzyki” – rubinki na skórze?
- FAQ. Czym są punkty rubinowe i jak powstają – często zadawane pytania
- Punkty rubinowe: podsumowanie informacji
Czerwone kropki na ciele jak pieprzyki. Czym są punkty rubinowe?
Punkty rubinowe, znane również jako naczyniaki rubinowe lub naczyniaki starcze, to niewielkie, czerwone zmiany skórne, które u wielu osób przypominają pieprzyki. Choć są łagodne i zazwyczaj niegroźne, ich nagłe pojawienie się może budzić niepokój pacjentów. Mają charakterystyczny czerwony, czasem purpurowy kolor i wyniosłość ponad powierzchnię skóry, często występują na tułowiu, ramionach lub udach.
>> Zobacz: Czerniak a pieprzyk – czym się różnią i jak je rozpoznać?
Zmiany te powstają w wyniku rozrostu drobnych naczyń krwionośnych (kapilar) w skórze właściwej. Ich intensywny czerwony kolor wynika z obecności utlenowanej hemoglobiny zawartej w krwi wypełniającej rozszerzone naczynia.
U kogo mogą pojawić się czerwone „pieprzyki” na ciele?
Naczyniaki rubinowe najczęściej pojawiają się po 30. roku życia, a ich liczba wzrasta z wiekiem. Według danych literaturowych, ponad 75% osób po 75. roku życia ma przynajmniej kilka takich zmian. Czynnikami predysponującymi są: genetyka, zaburzenia hormonalne, ciąża, a także ekspozycja na promieniowanie UV. Niektóre badania sugerują również możliwy związek z chorobami metabolicznymi, takimi jak cukrzyca czy hiperlipidemia.

Naczyniaki rubinowe: przyczyny rozwoju rubinków na ciele
Mechanizm powstawania punktów rubinowych nie jest do końca poznany. Uważa się, że dochodzi do miejscowego namnażania komórek tworzących ściany naczyń krwionośnych (komórek śródbłonka), co prowadzi do powstawania drobnych, łagodnych zmian naczyniowych w skórze. W badaniach histologicznych wykazano, że zmiany te nie są jedynie biernym poszerzeniem naczyń, lecz wykazują cechy aktywnego wzrostu — co oznacza, że mają charakter rzeczywistego rozrostu naczyń, a nie tylko ich rozszerzenia.
>> Przeczytaj: Czerniak a pieprzyk – czym się różnią i jak je rozpoznać?
Czy punkty rubinowe są niebezpieczne dla zdrowia?
W większości przypadków naczyniaki rubinowe są zmianami łagodnymi i nie stanowią zagrożenia dla zdrowia. Nie ulegają zezłośliwieniu. Ich nagły i liczny wysiew może jednak sugerować obecność stanu zapalnego, zmian hormonalnych lub — choć rzadko — rozwój chorób nowotworowych. Przykładem jest zespół POEMS, czyli rzadkie schorzenie związane z nieprawidłową produkcją białek (białko monoklonalne) przez komórki plazmatyczne w szpiku kostnym, które może powodować wiele objawów, w tym zmiany skórne. W takich sytuacjach wskazana jest konsultacja lekarska, by dokładnie ocenić przyczynę pojawienia się licznych punktów rubinowych.
Z czym można pomylić punkty rubinowe na skórze?
Najczęstszymi jednostkami, z którymi należy różnicować naczyniaki rubinowe, są:
- naczyniaki płaskie,
- malformacje kapilarne,
- ziarniniaki naczyniowe,
- czerniak amelanotyczny (rzadko, ale istotnie).
Charakterystyczny wygląd, wielkość (1-5 mm), intensywny kolor oraz brak objawów subiektywnych ułatwiają rozpoznanie kliniczne.
| Warto wiedzieć: W badaniach zauważono zwiększoną liczbę naczyniaków rubinowych u osób stosujących cyklosporynę – immunosupresant stosowany m.in. po przeszczepach narządów i w leczeniu łuszczycy. Może to sugerować rolę czynników immunologicznych w ich powstawaniu. |
Kiedy iść do lekarza z rubinkami na skórze?
Konsultacja dermatologiczna jest wskazana, jeśli:
- zmiana szybko rośnie,
- pojawia się krwawienie lub owrzodzenie,
- naczyniak jest bolesny lub swędzący ,
- występuje nagły, liczny wysiew.
>> Zobacz: Objawy skórne chorej wątroby. Jakie badania wykonać?
Jakie badania wykonać przy punktach rubinowych?
W typowych przypadkach nie ma potrzeby wykonywania badań dodatkowych. Gdy pojawia się nietypowy wygląd lub zmiany pojawiają się w dużej liczbie w krótkim czasie, lekarz może zlecić:
- dermoskopię,
- biopsję,
- badania hormonalne i metaboliczne (glukoza, lipidogram),
- badania w kierunku zespołów paraneoplastycznych.

Jak można usunąć czerwone „pieprzyki” – rubinki na skórze?
Zabiegi usuwania naczyniaków rubinowych są wykonywane głównie ze wskazań estetycznych, ponieważ zmiany te zazwyczaj nie stanowią zagrożenia dla zdrowia. Do najczęściej stosowanych metod należą:
- laseroterapia (z wykorzystaniem m.in. lasera barwnikowego, KTP czy Nd:YAG),
- elektrokoagulacja,
- kriochirurgia,
- klasyczne usunięcie chirurgiczne.
Wśród dostępnych technik najskuteczniejszą i najczęściej rekomendowaną jest laseroterapia, która pozwala na precyzyjne usunięcie zmiany przy minimalnym ryzyku powikłań i krótkim czasie rekonwalescencji. Wybór metody zależy od lokalizacji zmiany, jej wielkości, liczby oraz preferencji pacjenta i lekarza.
>> Sprawdź: Krosty na nogach – skąd się biorą i co mogą oznaczać?
Czy istnieją przeciwwskazania do usunięcia punktów rubinowych?
Tak, mimo że usuwanie naczyniaków rubinowych jest zabiegiem stosunkowo bezpiecznym, istnieją pewne przeciwwskazania, które należy wziąć pod uwagę. Do przeciwwskazań względnych zalicza się m.in.:
- skłonność do tworzenia bliznowców (blizn przerostowych),
- ciążę (w przypadku niektórych metod, zwłaszcza laseroterapii i elektrokoagulacji),
- zaburzenia krzepnięcia krwi,
- aktywne stany zapalne lub infekcje skóry w miejscu planowanego zabiegu.
Każdy przypadek powinien być oceniony indywidualnie przez lekarza dermatologa lub specjalistę medycyny estetycznej, aby dobrać najbezpieczniejsze i najskuteczniejsze postępowanie.
FAQ. Czym są punkty rubinowe i jak powstają – często zadawane pytania
Zrozumienie natury punktów rubinowych może budzić wątpliwości, zwłaszcza gdy na skórze pojawiają się nagle lub w dużej liczbie. Poniżej zebraliśmy odpowiedzi na najczęściej zadawane pytania, z którymi pacjenci zgłaszają się do lekarzy. To praktyczne kompendium rozwiewa obawy i porządkuje najważniejsze informacje.
Zazwyczaj nie. Naczyniaki rubinowe mają tendencję do utrzymywania się na skórze i z wiekiem mogą się powiększać.
Nie, są zmianami łagodnymi. W rzadkich przypadkach mogą wymagać diagnostyki.
Nie, o ile zachowują typowy wygląd. Zmiany atypowe lub szybko rosnące warto pokazać lekarzowi.
Punkty rubinowe: podsumowanie informacji
Punkty rubinowe to łagodne zmiany naczyniowe, które powstają wskutek rozrostu drobnych naczyń włosowatych w skórze właściwej. Najczęściej pojawiają się z wiekiem, choć ich dokładny mechanizm nie został w pełni wyjaśniony. Są nieszkodliwe, nie przekształcają się w zmiany złośliwe, ale mogą być wskazaniem do konsultacji dermatologicznej, szczególnie jeśli:
- gwałtownie się namnażają,
- zmieniają kolor lub kształt,
- pojawiają się w nietypowych miejscach (np. na piersiach, błonach śluzowych),
- krwawią lub ulegają urazom.
W razie potrzeby mogą być skutecznie i bezpiecznie usunięte metodami takimi jak laseroterapia, elektrokoagulacja czy kriochirurgia, jednak decyzja o zabiegu powinna być poprzedzona oceną lekarską.
Opieka merytoryczna: lek. Katarzyna Banaszczyk
Bibliografia
- Nazer RI., Bashihab RH., Al-Madani WH., Omair AA., AlJasser MI. Cherry angioma: A case-control study. J Family Community Med. 2020 May-Aug;27(2):109-113.
- Pastor-Tomás N., Bañuls J., Nagore E. [Translated article] Clinical Relevance of Cherry Angiomas. Actas Dermosifiliogr. 2023 Mar;114(3):T240-T246. English, Spanish.
- Buslach N., Foulad DP., Saedi N., Mesinkovska NA. Treatment Modalities for Cherry Angiomas: A Systematic Review. Dermatol Surg. 2020 Dec;46(12):1691-1697.
- Fernandez-Flores A., Colmenero I. Campbell de Morgan Spots (Cherry Angiomas) Show Endothelial Proliferation. Am J Dermatopathol. 2018 Dec;40(12):894-898.