Truskawki – dla wielu to smak lata, symbol słodkiego relaksu i radości z pierwszych ciepłych dni. Niestety nie każdy może cieszyć się tym owocowym przysmakiem bez obaw. U niektórych już po kilku minutach od zjedzenia pojawia się swędzenie w obrębie ust, wysypka, a nawet duszność. Co wtedy?
W tym artykule w przystępny sposób wyjaśniamy, czym jest alergia na truskawki, kto może być na nią narażony, jakie daje objawy i co można zrobić, by nad nią zapanować.
Spis treści:
- Skąd bierze się alergia na truskawki?
- Kto może być uczulony na truskawki?
- Objawy uczulenia na truskawki – na co zwrócić uwagę?
- Jak rozpoznać uczulenie na truskawki? Diagnostyka krok po kroku
- Co robić, gdy masz alergię na truskawki?
- Uczulenie na truskawki – najważniejsze informacje w skrócie
- Uczulenie na truskawki – FAQ
Skąd bierze się alergia na truskawki?
Alergia na truskawki to wynik nadreaktywności układu odpornościowego. Zamiast zignorować białka w owocach, organizm rozpoznaje je jako zagrożenie i zaczyna się bronić, produkując przeciwciała IgE, które uruchamiają reakcję alergiczną.
Naukowcy zidentyfikowali kilka kluczowych alergenów zawartych w truskawkach. Każdy z nich działa nieco inaczej i może dawać różne objawy:
Najważniejsze alergeny w truskawkach to:
- Fra a 1 (białko PR-10) – najczęściej wywołuje objawy w obrębie jamy ustnej – mrowienie, swędzenie, lekkie obrzęki. Wrażliwy na temperaturę – po obróbce cieplnej (np. w dżemie) zwykle nie powoduje reakcji.
- Fra a 3 (LTP – białko transportujące lipidy) – bardzo stabilny alergen, który może odpowiadać za cięższe reakcje ogólnoustrojowe, również po spożyciu przetworzonych truskawek.
- Fra a 4 (profilina) – białko panalergenowe obecne w wielu roślinach; zwykle powoduje łagodne objawy.
Co ciekawe, uczulenie na truskawki może mieć różne „oblicza” w zależności od regionu – u pacjentów z Europy Środkowej i Północnej (w tym Polski) najczęściej występuje alergia krzyżowa z pyłkami brzozy (Fra a 1), natomiast w rejonie śródziemnomorskim częściej obserwuje się reakcje na stabilne białka LTP (Fra a 3), nawet u osób bez uczulenia na pyłki.
U niektórych pacjentów objawy mogą być też związane z profilinami – białkami obecnymi w niemal każdej roślinie, które może dawać objawy po wielu różnych owocach i warzywach. Uczulenie na profiliny może być także przyczyną fałszywie dodatnich wyników sIgE w stosunku do ekstraktów wielu alergenów roślinnych i pokarmowych pochodzenia roślinnego.
Reaktywność krzyżowa w obrębie profilin jest bardzo wysoka i może wywoływać objawy zespołu pyłkowo-pokarmowego. Pyłki zawierające profiliny to m.in.:
- tymotka,
- brzoza,
- olcha,
- ambrozja
- bylica
Z pokarmów najczęściej reagują: pomidor, seler, melon, arbuz, kiwi, banan, marchew oraz orzechy laskowe.
>> Więcej o alergii przeczytaj: Wyleczyć się z alergii na pyłki – czy jest to możliwe?
Kto może być uczulony na truskawki?
Choć alergia może pojawić się w każdym wieku, najczęściej dotyka dzieci – ich układ odpornościowy dopiero się rozwija, a więc reaguje bardziej impulsywnie. Jednak nie tylko wiek ma znaczenie, istnieje kilka czynników ryzyka, które zwiększają szanse na rozwinięcie się uczulenia.
Do najczęstszych należą:
- historia rodzinna alergii – jeśli rodzice mają astmę, atopowe zapalenie skóry czy alergię pokarmową, ryzyko u dziecka rośnie.
- inne alergie – osoby uczulone na pyłki brzozy, jabłka, orzechy czy seler mogą reagować na truskawki przez tzw. alergię krzyżową.
- geografia –w krajach śródziemnomorskich dominują reakcje na LTP, a więc objawy po zjedzeniu truskawek mogą być cięższe.
- wiek –niemowlęta i małe dzieci są bardziej narażone, ale wiele z nich „wyrasta” z alergii z wiekiem.
| Pamiętaj: Nawet jeśli wcześniej jadłeś truskawki bez problemów, alergia może pojawić się nagle, np. po infekcji, silnym stresie czy zmianie środowiska. |
>> Chcesz zadbać o odporność organizmu – przeczytaj, jak wzmocnić układ immunologiczny u dorosłych i dzieci?
Objawy uczulenia na truskawki – na co zwrócić uwagę?
Objawy alergii mogą być bardzo różne – od delikatnych, ledwie zauważalnych do poważnych, wymagających natychmiastowej interwencji. Ich intensywność zależy m.in. od rodzaju alergenu, ilości spożytych truskawek i indywidualnej wrażliwości organizmu.
Objawy alergii na truskawki:
Objawy ze strony jamy ustnej (OAS)
Częste:
- mrowienie, swędzenie warg, języka, podniebienia,
- drapanie w gardle.
Rzadsze:
- obrzęk warg i języka,
- chrypka, utrudnione przełykanie.
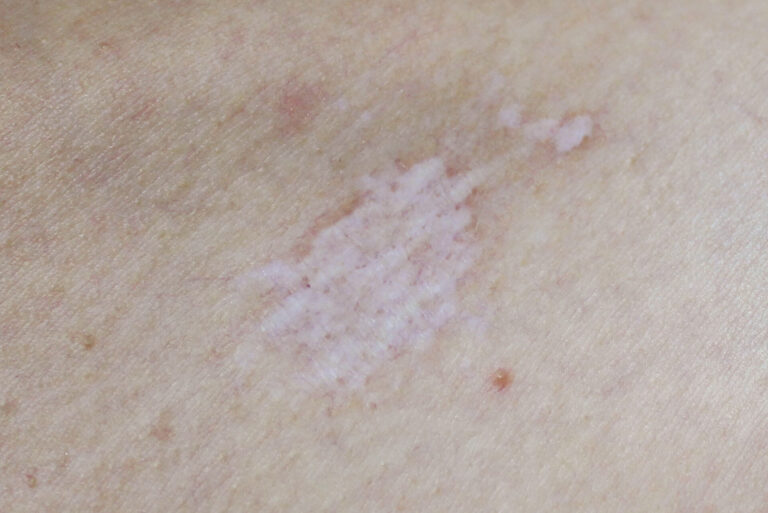
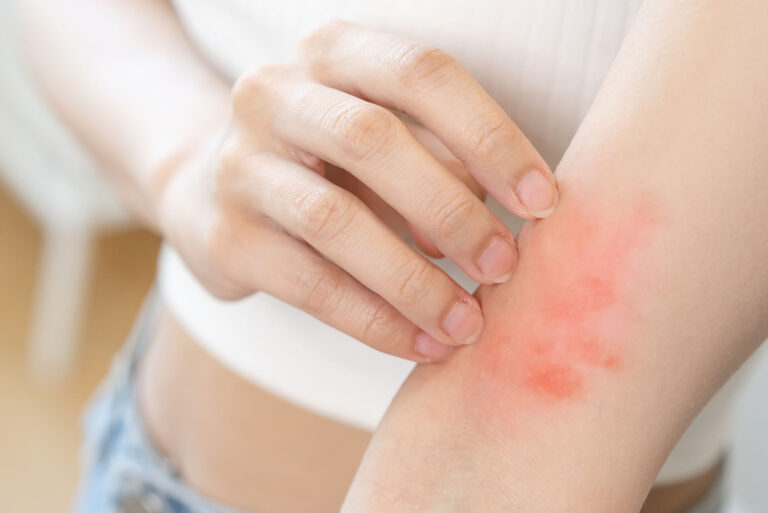
Objawy skórne
Częste:
- pokrzywka (swędzące bąble),
- drobna wysypka,
- zaczerwienienie i swędzenie.
Rzadsze:
- obrzęk naczynioruchowy (np. powieki, usta).
Objawy pokarmowe
Częste:
- bóle brzucha, skurcze jelit,
- nudności, wzdęcia brzucha, uczucie przelewania.
Rzadsze:
- wymioty,
- biegunka,
- uczucie pełności po niewielkiej ilości.
Objawy ogólnoustrojowe
Rzadsze, ale poważne:
- zawroty głowy,
- spadek ciśnienia,
- trudności z oddychaniem,
- omdlenie,
- wstrząs anafilaktyczny.
Większość osób zauważa objawy w ciągu kilkunastu minut od zjedzenia owoców, ale warto wiedzieć, że reakcja może pojawić się nawet po 24-48 godzinach. Wtedy trudniej ją skojarzyć z truskawkami.
Jak rozpoznać uczulenie na truskawki? Diagnostyka krok po kroku
Jeśli podejrzewasz u siebie lub dziecka alergię, najlepiej skonsultuj się z lekarzem alergologiem. Właściwa diagnoza to podstawa skutecznego leczenia i spokojniejszej głowy.
Diagnostyka alergii na truskawki:
- wywiad lekarski – kluczowy krok – pomaga połączyć objawy z możliwymi przyczynami.
- testy skórne (prick testy) – nakładany jest roztwór alergenu, a skóra delikatnie nakłuwana – zaczerwienienie oznacza reakcję.
- badania krwi (swoiste IgE): sprawdzają poziom przeciwciał IgE przeciwko alergenom truskawek.
- test prowokacji pokarmowej – pod nadzorem lekarza pacjent spożywa truskawki – metoda stosowana w trudniejszych przypadkach diagnostycznych.
Chcesz sprawdzić, czy masz alergię na truskawki? Sprawdź!

Dobrze przeprowadzona diagnostyka pozwala nie tylko wykryć uczulenie, ale także ustalić, na które białko konkretnie organizm reaguje – co ma ogromne znaczenie przy dalszym leczeniu.
Warto przeczytać też:
- Alergia IgE-zależna, czyli jaka?
- IgE całkowite – o czym świadczy wynik i w jakim celu przeprowadza się badanie?
Co robić, gdy masz alergię na truskawki?
Na szczęście z alergią można żyć – pod warunkiem, że się ją zna i potrafi unikać zagrożeń. W przypadku uczulenia na truskawki najważniejszym krokiem jest wyeliminowanie ich z diety.
Podstawowe zalecenia obejmują:
- unikanie nie tylko świeżych owoców, ale też przetworów (dżemy, jogurty, ciasta).
- czytanie etykiet – truskawki mogą być ukrytym składnikiem wielu produktów.
- uważność w restauracjach – zawsze informuj o uczuleniu.
- noszenie ampułkostrzykawki z adrenaliną – jeśli lekarz uzna to za konieczne.
Leczenie objawowe może obejmować:
- leki przeciwhistaminowe – na łagodne objawy (świąd, pokrzywka).
- kortykosteroidy – w silniejszych reakcjach skórnych.
- adrenalina – w sytuacjach zagrażających życiu, np. wstrząsu.
Kluczem jest świadomość i szybkie działanie, jeśli coś się dzieje.
Uczulenie na truskawki – najważniejsze informacje w skrócie
Czasem jedna truskawka potrafi wywołać wielką reakcję, dlatego warto pamiętać:
- alergia na truskawki to reakcja na konkretne białka – zwłaszcza Fra a 1 i Fra a 3.
objawy mogą dotyczyć skóry, jamy ustnej, przewodu pokarmowego i całego organizmu.
uczulenie na truskawki najczęściej występuje u dzieci, ale może dotyczyć każdego.
alergia krzyżowa z pyłkami brzozy (Fra a 1) daje łagodne objawy ustne.
Fra a 3 (LTP) odpowiada za reakcje ogólnoustrojowe i może być obecne również w przetworach. - objawy mogą wystąpić natychmiast lub z opóźnieniem.
- diagnostyka obejmuje wywiad, testy skórne, testy swoistych IgE i test prowokacji.
- leczenie opiera się na unikaniu truskawek i lekach objawowych.
- w razie zagrożenia życia konieczna jest adrenalina.
Uczulenie na truskawki – FAQ
To może być zespół alergii jamy ustnej (OAS) – typowa reakcja krzyżowa z pyłkami brzozy.
Tak, w wielu przypadkach tak się dzieje. Jednak każdą próbę ponownego wprowadzenia owoców warto skonsultować z alergologiem.
To mało prawdopodobne. Jeśli już, to raczej odwrotnie – osoby uczulone na Fra a 1 mogą reagować tylko na surowe truskawki, ale dobrze tolerować przetwory.
Bibliografia
- Andersen MB, Lucassen PL, Klinge B, Petersen A, Bindslev-Jensen C, Poulsen LK. Identification of European allergy patterns to the allergen families PR-10, LTP, and profilin from Rosaceae fruits. Clin Transl Allergy. 2009;1(1):1–9.
- Aninowski, M.; Kazimierczak, R.; Hallmann, E.; Rachtan-Janicka, J.; Fijoł-Adach, E.; Feledyn-Szewczyk, B.; Majak, I.; Leszczyńska, J. Evaluation of the Potential Allergenicity of Strawberries in Response to Different Farming Practices. Metabolites 2020, 10, 102.
- Hassan, A.K.G.; Venkatesh, Y.P. An overview of fruit allergy and the causative allergens. Eur Ann Allergy Clin Immunol 2015, 47, 180-187.
- Zuidmeer, L.; Salentijn, E.; Rivas, M. F.; Mancebo, E. G.; Asero, R.; Matos, C. I.; Pelgrom, K. T. B.; Gilissen, L. J. W. J.; van Ree, R. The role of profilin and lipid transfer protein in strawberry allergy in the Mediterranean area. Clinical & Experimental Allergy 2006, 36, 666-675.