Leki przeciwzakrzepowe, czyli antykoagulanty, często są nazywane lekami rozrzedzającymi krew. Zajmują bardzo ważne miejsce w zapobieganiu groźnym powikłaniom miażdżycy – zawałom serca czy udarom. Są również polecane pacjentom po zabiegach stentowania. Czy pacjenci przyjmujący te leki powinni przestrzegać specjalnych zaleceń żywieniowych? Zapraszamy do artykułu!
Spis treści:
- Leki przeciwzakrzepowe – podział
- Leki przeciwpłytkowe a składniki diety
- Antagoniści witaminy K a składniki diety
- Doustne leki przeciwzakrzepowe nowej generacji
- Dieta przy lekach przeciwzakrzepowych. Podsumowanie
- Dieta podczas stosowania leków przeciwkrzepliwych – często zadawane pytania
Leki przeciwzakrzepowe – podział
Leki przeciwzakrzepowe są niejednorodną grupą leków, należą do nich:
- leki przeciwpłytkowe, które hamują agregację (zlepianie się) płytek krwi, np. klopidogrel i kwas acetylosalicylowy,
- antagoniści witaminy K, np. warfaryna i acenokumarol,
- doustne leki przeciwzakrzepowe nowej generacji, często określane jako NOAC (novel oral anticoagulants) lub DOAC (direct oral anticoagulants), np. rywaroksaban, dabigatran, apiksaban.
Leki przeciwpłytkowe a składniki diety
Do leków przeciwpłytkowych zalicza się kwas acetylosalicylowy oraz klopidogrel. Kwas acetylosalicylowy (Acard) to lek należący do NLPZ (Niesteroidowych Leków Przeciwzapalnych), ale w tym przypadku wykorzystuje się przeciwpłytkowy mechanizm jego działania.
Leków przeciwpłytkowych nie należy łączyć z:
- miłorzębem japońskim (Ginkgo biloba) – suplement stosowany w celu poprawy pamięci i koncentracji. Należy jednak pamiętać, iż jest to również roślina, która hamuje agregację płytek krwi i tworzenie się skrzepów. Dlatego nie należy go stosować w połączeniu z lekami przeciwpłytkowymi, ponieważ może to wzmacniać ich działanie i przyczyniać się do wydłużenia czasu krwawienia i zwiększenia ryzyka krwawień.
- żeń-szeniem – adaptogen również stosowany w celu poprawy funkcji kognitywnych czy łagodzenie skutków stresu, wykazujący działanie przeciwpłytkowe. Chociaż badania kliniczne wskazują, iż jednoczesna suplementacja zeń-szeniem u pacjentów zażywających leki przeciwpłytkowe wywołuje niewielkie ryzyko krwawienia, to osoby planujące stosowanie żeń-szenia powinny być świadome istnienia takiego zagrożenia.
- alkoholem – alkoholu nie powinno się łączyć z żadnymi lekami, jednak szczególnie dotyczy to kwasu acetylosalicylowego (aspiryny, Acardu), ponieważ hamuje on aktywność dehydrogenazy alkoholowej, wydłużając czas rozkładania i usuwania alkoholu z organizmu.
- czosnkiem – zawarta w czosnku allicyna hamuje agregację płytek, nasilając działanie leków przeciwpłytkowych.
- witaminami C i witamina E – dieta bogata w te witaminy nasila wytwarzanie enzymu paraoksonazy 1 (PON 1), który wpływa na reakcję organizmu na lek przeciwpłytkowy – klopidogrel.
>> Sprawdź też: Talerz zdrowego żywienia

Antagoniści witaminy K a składniki diety
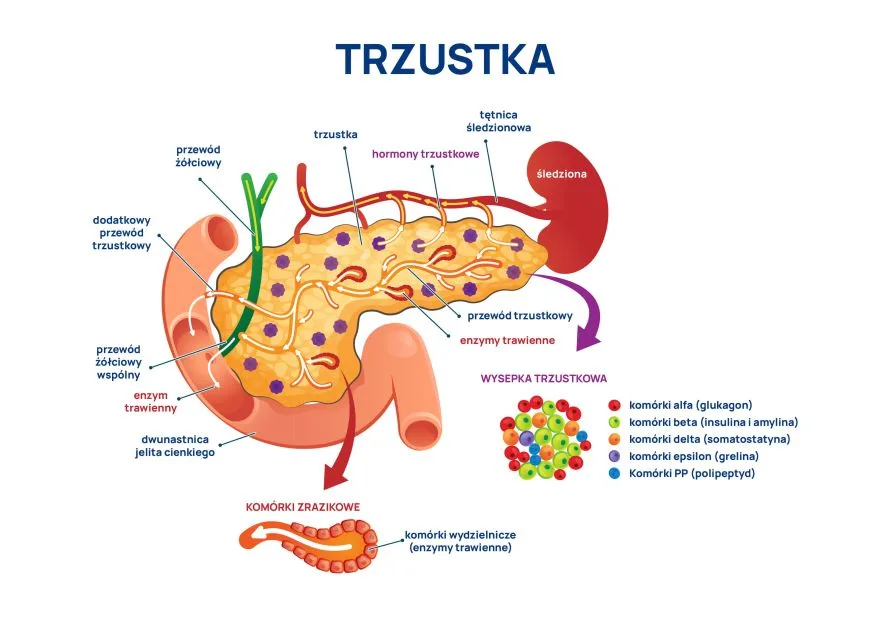
Do grupy leków przeciwkrzepliwych będących antagonistami witaminy K należą warfaryna i acenokumarol. Mechanizm ich działania polega na hamowaniu działania witaminy K, która jest czynnikiem niezbędnym w procesie krzepnięcia krwi. Dlatego pokarmy bogate w tę witaminę hamują efekt terapeutyczny warfaryny i acenokumarolu.
Witamina K obecna jest w zielonych warzywach – wszystkie jadalne zielone części roślin uznawane są za ważne źródło witaminy K.
Czego unikać, jeśli zażywamy warfarynę lub acenokumarol? Za najbogatsze źródło witaminy K uważa się rośliny zawierające ponad 100 μg w 100 g produktu. Należą do nich:
- szpinak,
- jarmuż,
- zielona sałata,
- brukselka,
- zielona herbata.
Również rośliny zawierające 50 – 100 μg witaminy K w 100 g produktu hamują działanie tych leków. Są to:
- kapusta,
- kalafior,
- awokado.
Bogate w witaminę K są zioła i przyprawy, przy czym produkty w postaci suszonej zawierają jej więcej niż rośliny świeże. Należy unikać:
- majeranku,
- oregano,
- cząbru,
- mięty,
- pokrzywy,
- czosnku niedźwiedziego,
- mniszka lekarskiego,
- szałwii,
- rumianku,
- natki pietruszki.
Antagonistów witaminy K nie należy popijać sokiem grejpfrutowym czy żurawinowym. Polifenole zawarte w tych owocach, podobnie jak w jagodach goi, hamują metabolizm warfaryny i mogą prowadzić do nasilonych krwotoków (wartość wskaźnika INR wzrasta). Innym polifenolem wykazującym takie działanie jest resweratrol.
W przypadku większości witamin obróbka kulinarna (gotowanie, podgrzewanie w mikrofali, pieczenie) zmniejsza ich zawartość w pokarmach. Witamina K jest odporna na takie działania, należy mieć to na uwadze, przygotowując posiłki z warzywami bogatymi w tę witaminę.
Ważnym źródłem witaminy K są oleje:
- sojowy,
- rzepakowy,
- oliwa z oliwek.
Są one często używane w potrawach, których podstawę stanowią warzywa i mogą być dodatkowym źródłem problemów z aktywnością warfaryny lub acenokumarolu.
Działanie przeciwzakrzepowe leków z grupy antagonistów witaminy K osłabia także wątróbka zwierzęca i białko jaj, płatki owsiane.
Ciekawe jest to, iż hamujący wpływ witaminy K z żywności na działanie warfaryny zależy częściowo od genotypu pacjenta. Znaczenie mają polimorfizmy dwóch genów: CYP2C19, VKORC1, a ich obecność można sprawdzić w panelu farmakogenetycznym.
Więcej o tym w jaki sposób geny mogą wpływać na reakcję organizmu na leki przeciwkrzepliwe w artykule: Leki przeciwzakrzepowe – badanie farmakogenetyczne w bezpiecznej terapii

Doustne leki przeciwzakrzepowe nowej generacji
Doustne leki przeciwzakrzepowe nowej generacji (NOAC – Novel Oral Anticoagulants / DOAC – Direct Oral Anticoagulants), np. rywaroksaban, dabigatran, apiksaban, to preparaty, które powstały w odpowiedzi na zapotrzebowanie świata medycznego na leki przeciwkrzepliwe, które nie mają tak dużych ograniczeń dietetycznych, jak antagoniści witaminy K, oraz monitorowania terapii.
Są to leki, które nie wchodzą w interakcje ze składnikami diety, dlatego są wygodniejsze w stosowaniu, pacjent nie jest ograniczony w wyborze menu. Wyjątkiem jest sok grejpfrutowy, który nasila działanie apiksabanu i w mniejszym stopniu rywaroksabanu, jednoczesne picie tego soku i przyjmowanie leków z grupy DOAC może prowadzić do krwawień.
Leki na rozrzedzenie krwi – skutki uboczne a dieta
Apiksaban i riwaroksaban to leki, które często powodują skutki uboczne w postaci niedokrwistości. Dlatego w czasie ich stosowania należy dbać o dietę, która będzie zapobiegała anemii.
O tym, jak dobrze odżywiać się przy niedokrwistości, dowiesz się więcej z artykułu: Dieta w anemii. Co jeść, by zmniejszyć niedobory żelaza?
Dieta przy lekach przeciwzakrzepowych. Podsumowanie
- Leki przeciwkrzepliwe to niejednorodna grupa preparatów. Najwięcej ograniczeń dietetycznych mają pacjenci zażywający leki z grupy antagonisów witaminy K – warfarynę lub acenokumarol.
- W czasie przyjmowania leków rozrzedzających krew nie należy przyjmować żadnych suplementów bez konsultacji z lekarzem, farmaceutą lub dietetykiem.
- Leki przeciwkrzepliwe (podobnie jak wszystkie leki) należy popijać tylko wodą.
- Doustne leki przeciwkrzepliwe nowej generacji często wywołują niedokrwistość, dlatego w czasie ich przyjmowania należy zadbać o profilaktykę anemii.
Dieta podczas stosowania leków przeciwkrzepliwych – często zadawane pytania
Kawa nie jest przeciwskazana przy lekach przeciwzakrzepowych, nie należy jednak ich popijać kawą. Warto jednak pamiętać, iż kawa może modyfikować reaktywność płytek krwi, dlatego należy ją spożywać w rozsądnych ilościach.
Miód i inne produkty pszczele (np. jad pszczeli) zawierają czynniki przeciwzakrzepowe, które mogą wydłużać czas krzepnięcia krwi i nasilać działanie leków przeciwzakrzepowych.
Płatki owsiane należą do grupy produktów zawierających 50-100 µg witaminy K w 100 g produktu, z tego powodu należy je spożywać z ostrożnością przy zażywaniu leków przeciwzakrzepowych. Na porcję owsianki zazwyczaj używa się ok. 80 g płatków, dlatego spożycie owsianki raz na jakiś czas dopuszczalne. Należy również zachować odstęp czasowy pomiędzy owsianką a lekami.
Wiele badań wskazuje, iż siemię lniane nie wywiera istotnego wpływu na krzepliwość krwi, dlatego jego stosowanie nie jest przeciwskazane podczas przyjmowania leków rozrzedzających krew.
Witamina D nie wchodzi w interakcje z lekami przeciwzakrzepowymi. Można ją stosować równocześnie z tymi preparatami.
Nie ma przeciwwskazań do przyjmowania witaminy B12 w trakcie terapii lekami rozrzedzającymi krew. Można ją równocześnie stosować.
Nie. W czasie przyjmowania leków przeciwzakrzepowych z grupy antagonistów witaminy K (warfaryna, aenokumarol) należy unikać spożywania żurawiny i jej przetworów.
Bibliografia
- Raval, Amish N et al. “Management of Patients on Non-Vitamin K Antagonist Oral Anticoagulants in the Acute Care and Periprocedural Setting: A Scientific Statement From the American Heart Association.” Circulation vol. 135,10 (2017): e604-e633. doi:10.1161/CIR.0000000000000477
- L. Woźniacka-Leśkiewicz, A. Wolska-Bułach, A. Tykarski, Interakcje antykoagulantów z lekami i żywnością — wskazówki dla lekarza praktyka, Choroby Serca i Naczyń 2014, 11 (2), 78–90
- I. Zieleń-Zynek, J. Kowalska, A. Będkowska-Szczepańska et al., Interakcje wybranych leków kardiologicznych ze składnikami diety, Folia Cardiologica 2019; 14, 1: 46–51
- Duda-Chodak A, Tarko T. Possible Side Effects of Polyphenols and Their Interactions with Medicines. Molecules. 2023 Mar 10;28(6):2536. doi: 10.3390/molecules28062536. PMID: 36985507; PMCID: PMC10058246.
- Mladěnka P, Macáková K, Kujovská Krčmová L, Javorská L, Mrštná K, Carazo A, Protti M, Remião F, Nováková L; OEMONOM researchers and collaborators. Vitamin K – sources, physiological role, kinetics, deficiency, detection, therapeutic use, and toxicity. Nutr Rev. 2022 Mar 10;80(4):677-698. doi: 10.1093/nutrit/nuab061. PMID: 34472618; PMCID: PMC8907489.
- CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Apixabanum Teva, 2,5 mg, tabletki powlekane
- CHARAKTERYSTYKA PRODUKTU LECZNICZEGO, Xarelto 10 mg tabletki powlekane
- https://www.alab.pl/centrum-wiedzy/z-czym-nie-laczyc-witamin-d-c-i-innych-interakcje-witamin-z-lekami/
- Olas B, Bryś M. Effects of coffee, energy drinks and their components on hemostasis: The hypothetical mechanisms of their action. Food Chem Toxicol. 2019 May;127:31-41. doi: 10.1016/j.fct.2019.02.039. Epub 2019 Mar 4. PMID: 30844438.
- Zolfagharian H, Mohajeri M, Babaie M. Honey Bee Venom (Apis mellifera) Contains Anticoagulation Factors and Increases the Blood-clotting Time. J Pharmacopuncture. 2015 Dec;18(4):7-11. doi: 10.3831/KPI.2015.18.031. PMID: 26998384; PMCID: PMC4797586.
- Tohgi N. Effect of alpha-linolenic acid-containing linseed oil on coagulation in type 2 diabetes. Diabetes Care. 2004 Oct;27(10):2563-4. doi: 10.2337/diacare.27.10.2563. PMID: 15451940.