Ucho ludzkie to jeden z najbardziej wyspecjalizowanych narządów w ciele człowieka. Dzięki niemu nie tylko słyszymy dźwięki, ale także utrzymujemy równowagę i orientację w przestrzeni. Choć na pierwszy rzut oka niewielkie i niepozorne, skrywa w sobie struktury współpracujące ze sobą, z niezwykłą dokładnością. Czym dokładnie jest ucho, z jakich części się składa?
Spis treści:
- Jak zbudowane jest ucho?
- Funkcje układu słuchowego: dlaczego tak właśnie jest zbudowane ucho?
- Budowa ucha: jak wpływa na proces słyszenia?
- Najczęstsze choroby układu słuchowego i ucha ludzkiego
- Budowa ucha a jego pielęgnacja: jak dbać o układ słuchowy?
- Budowa ucha ludzkiego: podsumowanie informacji
Jak zbudowane jest ucho?
Ucho to niezwykle precyzyjny i złożony narząd, który pełni podwójną funkcję — odpowiada zarówno za odbieranie dźwięków, jak i za utrzymanie równowagi. Zbudowane jest z trzech anatomicznych części:
- ucha zewnętrznego;
- ucha środkowego;
- ucha wewnętrznego.
Należy pamiętać, że każda z nich spełnia ściśle określoną funkcję w procesie percepcji dźwięku.
>> Sprawdź: Ostre zapalenie ucha środkowego u dzieci – jeden z najczęstszych problemów małych dzieci
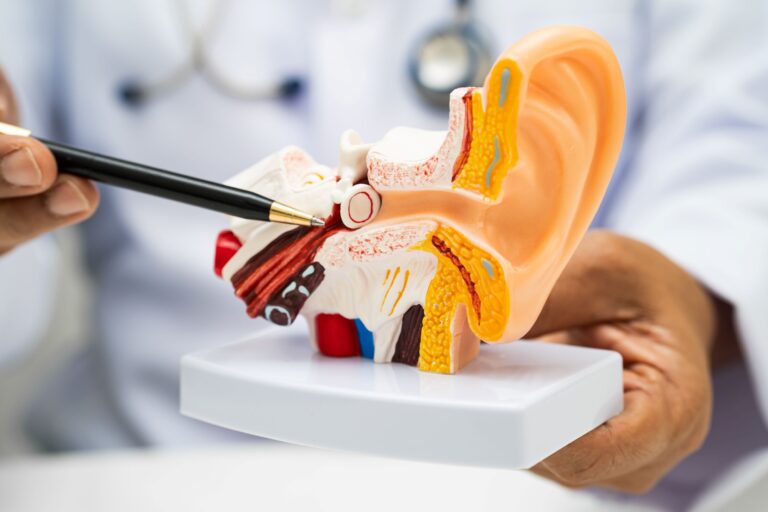
Budowa ucha zewnętrznego
Ucho zewnętrzne to pierwszy odcinek drogi słuchowej, odpowiedzialny za wychwytywanie i kierowanie fal dźwiękowych w głąb układu słuchowego. Składa się z dwóch elementów:
- małżowiny usznej;
- przewodu słuchowego zewnętrznego, który kończy się błoną bębenkową.
Małżowina uszna, utworzona z elastycznej chrząstki pokrytej cienką warstwą skóry, pełni funkcję „anteny”, zbierającej dźwięki z otoczenia i kierującej je do wnętrza przewodu. Sam przewód słuchowy ma długość około 2,5 cm i dzieli się na część chrzęstną (związaną z małżowiną) oraz kostną (przylegającą do kości skroniowej). Jego ściany wyścielone są skórą wyposażoną w gruczoły łojowe i woskowinowe oraz krótkie włosy, które pełnią funkcję ochronną przed zanieczyszczeniami.
Na końcu przewodu znajduje się błona bębenkowa — cienka, ale wytrzymała struktura o nieregularnym, eliptycznym kształcie, stanowiąca granicę między uchem zewnętrznym a środkowym.

Budowa ucha środkowego
Ucho środkowe to precyzyjnie zaprojektowana przestrzeń anatomiczna, zlokalizowana w kości skroniowej, która odgrywa kluczową rolę w przenoszeniu drgań dźwiękowych z ucha zewnętrznego do ucha wewnętrznego. Jego głównym elementem jest jama bębenkowa — wypełniona powietrzem, wąska komora, w której znajdują się trzy najmniejsze i najbardziej precyzyjne kosteczki ludzkiego ciała:
- młoteczek;
- kowadełko;
- strzemiączko.
Tworzą one ruchomy łańcuch, który przekazuje drgania z błony bębenkowej na błonę okienka owalnego, wzmacniając jednocześnie dźwięk. Całość wspierają dwa drobne, ale istotne mięśnie:
- mięsień napinacz błony bębenkowej;
- mięsień strzemiączkowy.
Chronią one narząd słuchu przed nadmiernym natężeniem dźwięku. Integralną częścią ucha środkowego jest również trąbka słuchowa (Eustachiusza), łącząca jamę bębenkową z gardłem. Jej funkcją jest wyrównywanie ciśnienia po obu stronach błony bębenkowej, co umożliwia prawidłowe przewodzenie fal akustycznych.
>> To może Cię zainteresować: Zawroty głowy i ich możliwe przyczyny. Jakie badania należy przeprowadzić?
Budowa ucha wewnętrznego
Ucho wewnętrzne to najbardziej złożona część narządu słuchu, odpowiedzialna nie tylko za przetwarzanie dźwięków, ale także za utrzymanie równowagi. Składa się z dwóch współistniejących struktur:
- błędnika kostnego;
- błędnika błoniastego (mieszczącego się we wnętrzu błędnika kostneg).
Całość wypełniona jest specjalistycznymi płynami – perylimfą i endolimfą – których ruchy odgrywają kluczową rolę w przewodzeniu bodźców.
W skład błędnika kostnego wchodzą:
- ślimak;
- przedsionek;
- trzy kanały półkoliste.
Ślimak, przypominający spiralnie zwiniętą muszlę, zawiera narząd Cortiego – precyzyjny zestaw komórek rzęsatych i podporowych, które przekształcają fale mechaniczne w impulsy nerwowe przesyłane do mózgu za pośrednictwem nerwu przedsionkowo-ślimakowego (VIII nerwu czaszkowego). Przedsionek i kanały półkoliste tworzą natomiast część statyczną błędnika, odpowiedzialną za rejestrowanie zmian położenia głowy i utrzymanie równowagi.
Funkcje układu słuchowego: dlaczego tak właśnie jest zbudowane ucho?
Układ słuchowy człowieka to precyzyjnie zaprojektowany system biologiczny, którego budowa bezpośrednio wynika z pełnionych funkcji – odbioru, wzmacniania, przekształcania i przekazywania dźwięków do mózgu. Każda z trzech głównych części ucha – zewnętrzne, środkowe i wewnętrzne – odgrywa w tym procesie niezastąpioną rolę.
Małżowina uszna i przewód słuchowy stanowią pierwszy etap drogi akustycznej – kierują i wzmacniają fale dźwiękowe, które następnie wprawiają w drgania błonę bębenkową. Te mikroskopijne wibracje są przenoszone przez trzy kosteczki słuchowe – młoteczek, kowadełko i strzemiączko – do ucha wewnętrznego, gdzie strzemiączko porusza płyn wewnątrz ślimaka. Tam, w narządzie Cortiego, drgania mechaniczne zostają przekształcone w impulsy elektryczne, które przez nerw słuchowy trafiają do kory mózgowej.
Woskowina w uchu – czy spełnia jakąś funkcję?
Woskowina w uchu pełni szereg niezwykle istotnych funkcji ochronnych. Ta naturalna substancja powstaje w przewodzie słuchowym zewnętrznym jako mieszanka wydzielin gruczołów łojowych i apokrynowych oraz złuszczonych komórek naskórka.
Jej głównym zadaniem jest ochrona ucha przed szkodliwymi czynnikami zewnętrznymi – zatrzymuje kurz, bakterie, a nawet drobne owady, zanim te dostaną się głębiej do struktur słuchowych. Co więcej, dzięki właściwościom natłuszczającym i lekko kwaśnemu odczynowi, wspomaga utrzymanie odpowiedniego nawilżenia nabłonka i hamuje rozwój patogenów.
>> Przeczytaj: Wybrane wskaźniki stanu zapalnego
Budowa ucha: jak wpływa na proces słyszenia?
To, jak słyszymy, wynika bezpośrednio z fizycznej i funkcjonalnej budowy ucha. Kształt małżowiny usznej umożliwia selektywny odbiór dźwięków z otoczenia, szczególnie tych dochodzących z przodu, co wpływa na lokalizację źródła dźwięku. Ucho środkowe, dzięki kosteczkom słuchowym i układowi dźwigni, wzmacnia fale dźwiękowe nawet 20-krotnie, zanim dotrą do ślimaka. Natomiast ślimak, dzięki swojej spiralnej budowie, rozkłada dźwięk na poszczególne częstotliwości, pozwalając nam słyszeć zarówno szept, jak i wysokie tony instrumentów muzycznych.
Najczęstsze choroby układu słuchowego i ucha ludzkiego
Zarówno u dzieci, jak i dorosłych, mogą występować różne dolegliwości obejmujące ucho zewnętrzne, środkowe i wewnętrzne:
- zapalenie ucha środkowego – częsta infekcja, szczególnie u dzieci, początkowo wirusowa, a następnie bakteryjna. Może przybrać postać ostrą lub przewlekłą, prowadząc niekiedy do powikłań, takich jak perlak;
- perlak ucha – przewlekłe zapalenie ucha środkowego z tworzeniem guza zapalnego;
- zapalenie ucha zewnętrznego – często spowodowane urazem (np. patyczkiem higienicznym) lub infekcją bakteryjną bądź wirusową. Objawia się bólem, obrzękiem i świądem w przewodzie słuchowym;
- niedosłuch – może mieć różne przyczyny: od przewlekłych infekcji u dzieci, przez uszkodzenia słuchu u dorosłych (np. hałas), aż po naturalne zmiany związane z wiekiem.
>> Zobacz: Utrata (brak) węchu i smaku – przyczyny, jak długo trwa, leczenie
Budowa ucha a jego pielęgnacja: jak dbać o układ słuchowy?
Ucho, jako niezwykle czuły i złożony narząd, wymaga szczególnej troski – zarówno pod względem higieny, jak i codziennej ochrony. Jego delikatna budowa sprawia, że niewłaściwe nawyki mogą łatwo prowadzić do podrażnień, infekcji, a nawet trwałych uszkodzeń słuchu. Dlatego warto świadomie dbać o układ słuchowy, kierując się zasadami zgodnymi z jego fizjologią:
- chroń słuch przed hałasem – zarówno krótkotrwały, intensywny hałas, jak i długotrwała ekspozycja na głośne dźwięki (koncerty, hałaśliwe środowisko pracy) mogą prowadzić do nieodwracalnych uszkodzeń. Używaj zatyczek do uszu lub słuchawek ochronnych;
- unikaj patyczków kosmetycznych do czyszczenia – mimo że wydają się pomocne, mogą jedynie wpychać woskowinę głębiej, powodując jej zaleganie lub urazy mechaniczne. Zamiast tego warto sięgać po delikatne preparaty do higieny uszu dostępne w aptekach;
- używaj słuchawek nausznych zamiast dokanałowych – te drugie działają zbyt blisko błony bębenkowej;
- dbaj o profilaktykę – regularne wizyty u laryngologa i kontrola słuchu, szczególnie w przypadku podejrzenia niedosłuchu lub częstych infekcji, pozwolą na wczesne wykrycie problemów.
>> Sprawdź także: Dysmorfia – co to jest? Jakie są jej przyczyny i objawy?
Budowa ucha ludzkiego: podsumowanie informacji
Podsumowując:
- ucho zewnętrzne obejmuje małżowinę uszną i przewód słuchowy zewnętrzny, który kończy się błoną bębenkową. Odpowiada za wychwytywanie i kierowanie fal dźwiękowych;
- ucho środkowe to przestrzeń wypełniona powietrzem, w której znajdują się trzy kosteczki słuchowe (młoteczek, kowadełko, strzemiączko). Ich zadaniem jest wzmacnianie i przekazywanie drgań do ucha wewnętrznego;
- ucho wewnętrzne tworzy błędnik kostny i błoniasty. Znajdują się tu ślimak – odpowiedzialny za odbiór i analizę dźwięków – oraz kanały półkoliste i przedsionek odpowiadające za utrzymanie równowagi;
- całość współpracuje z nerwem przedsionkowo-ślimakowym (VIII nerwem czaszkowym), który przewodzi impulsy nerwowe do mózgu;
- precyzyjna budowa ucha umożliwia zarówno odbiór dźwięków o różnym natężeniu, jak i kontrolę nad orientacją przestrzenną.
Zrozumienie, jak działa układ słuchowy, to pierwszy krok do jego skutecznej ochrony. Regularna profilaktyka, świadoma pielęgnacja i wczesna diagnostyka są kluczem do zachowania zdrowego słuchu na długie lata. Zadbaj o swoje uszy – wykonuj okresowe badania słuchu i nie lekceważ pierwszych objawów problemów!
Opieka merytoryczna: lek. Sara Aszkiełowicz
Bibliografia
- Poulton, S., Yau, S., Anderson, D., & Bennett, D. (2015). Ear wax management. Australian family physician, 44(10), 731–734.
- Dąbrowski P., Nawracające infekcje uszu, Choroby laryngologiczne w POZ, 2018.
- https://henrykskarzynski.pl/wp-content/uploads/2021/11/Sliwinska-Kowalska-M_Audiologia-kliniczna.pdf [dostęp: 13.04.2025]
- https://sound.eti.pg.gda.pl/student/pp/roz2.pdf [dostęp: 13.04.2025]
- http://wlf-info-platforma.wwsi.edu.pl/material/bsiInfoPlus/mibio/s2/bsiInfoPlus_mibio_s2_PoEdycjiUcho.pdf [dostęp: 13.04.2025]
- https://pacjent.gov.pl/aktualnosc/jak-dbac-o-sluch [dostęp: 13.04.2025]