Ból kolan lub ból kolana to bardzo częsta dolegliwość, która może pojawić się w każdym wieku – zarówno u dzieci, u osób dorosłych, jak i u seniorów. Artykuł omawia problematykę bólu w kolanach u dorosłych. Zapraszamy do lektury.
| Z tego artykułu dowiesz się: >> jak zbudowany jest staw kolanowy – największy staw organizmu człowieka, >> jakie mogą być przyczyny bólu w kolanie, >> kiedy może wystąpić ostry, nagły ból kolana bez urazu, >> do jakiego lekarza zwrócić się w przypadku problemów z kolanami, >> jakie badania wykonuje się w diagnostyce bólu w stawie kolanowym, >> jakie może być leczenie w bólu kolan i czy istnieją domowe sposoby łagodzące ból w kolanach. |
Spis treści:
- Budowa kolana
- Ból kolan – przyczyny
- Ból kolana – czynniki sprzyjające
- Ból kolana – kiedy zgłosić się do lekarza?
- Diagnostyka bólu kolan
- Ból kolana – leczenie
- Podsumowanie
- Ból kolana – sekcja FAQ
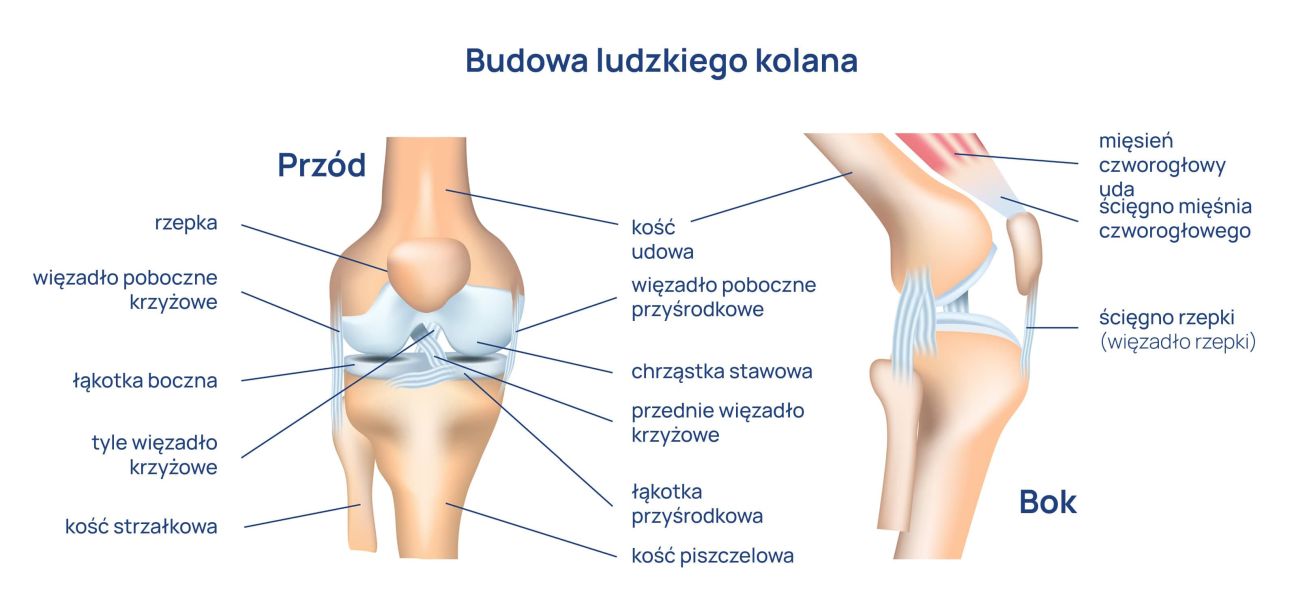
Budowa kolana
Kolano to największy staw ludzkiego organizmu, a jednocześnie jednym z najbardziej wrażliwych i ulegających uszkodzeniom. Znajomość jego budowy jest informacją istotną z punktu widzenia umiejscowienia dolegliwości bólowych. Jeśli wiemy, gdzie są położone poszczególne elementy stawu kolanowego, łatwiej zidentyfikować źródło bólu.
Anatomia kolana
Anatomia kolana obejmuje:
- Kość udową, piszczelową i rzepkę. Złamanie rzepki może objawiać się silnym, nagłym bólem z przodu kolana, nasilającym się przy ruchu, obrzękiem, zasinieniem oraz brakiem możliwości prostowania nogi.
- Łąkotkę – boczną i przyśrodkową. Łąkotka przyśrodkowa jest umocowana silniej niż boczna, dlatego jej uszkodzenie jest znacznie częstsze i może wywoływać ból kolana po wewnętrznej stronie. Charakterystyczny jest wówczas ból kolana przy jego zginaniu, poza tym uczucie blokowania i przeskakiwania. Natomiast uszkodzenie łąkotki bocznej może powodować ból kolana po zewnętrznej stronie.
- Więzadła – wspólnie z pasmami pochodzącymi z powięzi szerokiej uda – silnie wzmacniają torebkę stawową. Są to więzadła rzepki, więzadła poboczne (piszczelowe i strzałkowe, które mają za zadanie hamowanie ruchu obrotowego kolana na zewnątrz), więzadła podkolanowe, więzadła krzyżowe (przednie, tylne, hamujące ruchy obrotowe do wewnątrz), więzadło poprzeczne.
Mechanika stawu kolanowego
Staw kolanowy jest również miejscem przyczepu wielu mięśni, które warunkują ruchy stawu kolanowego. Kolano to tzw. staw zawiasowy, którego podstawowe ruchy to zgięcie i prostowanie. Staw ma tylko jeden mięsień prostujący i jest to mięsień czworogłowy uda, natomiast cały szereg mięśni zginających.
| Pamiętaj: Udział mięśnia czworogłowego uda w prostowaniu kolana i jego przewaga nad zginaczami jest charakterystyczna dla człowieka. Wynika to z faktu, iż przy podnoszeniu ciała z pozycji klęczącej lub kucznej, staw kolanowy i biodrowy prostują się wbrew sile ciężkości, dodatkowo dźwigając całą górną część ciała. |
Główne zginacze stawu kolanowego, wykonujące ok. 90% całej pracy, to mięśnie:
- półbłoniasty,
- półścięgnisty,
- dwugłowy uda.
Pozostałe zginacze to mięśnie:
- smukły,
- krawiecki,
- podkolanowy,
- brzuchaty łydki.
| Warto pamiętać: Stan zapalny lub przeciążenie w miejscu przyczepu mięśni (półścięgnistego, smukłego, krawieckiego), to tzw. zespół gęsiej stopki, wywołujący ból kolana z boku, po wewnętrznej stronie. Natomiast uszkodzenie mięśni i ścięgien mięśnia podkolanowego i/lub dwugłowego uda, może powodować ból z tyłu kolana. |
Ból kolan – przyczyny
Ból kolana może być objawem wielu problemów, sam w sobie nie jest chorobą, dlatego w klasyfikacji ICD-10 nie znajdziemy takiej frazy.
Przykładowe kody ICD-10 dla bólu kolan to:
- S80-S89 – urazy kolana i podudzia,
- S83 – zwichnięcie, skręcenie, naderwanie więzadeł i stawów kolanowych,
- M17 – gonartroza (choroba zwyrodnieniowa stawu kolanowego),
- M23 – wewnętrzne uszkodzenie stawu kolanowego. Ból kolana może być również ukryty pod innymi kodami klasyfikacji, co dobrze obrazuje fakt, iż jego przyczyny mogą być bardzo różnorodne.
Ból kolana może być spowodowany nieprawidłowościami dotyczącymi samego stawu, a także struktur go otaczających (mięśni). Bywa także objawem chorób ogólnoustrojowych, takich jak np. reumatoidalne zapalenie stawów. U młodszych pacjentów częstą przyczyną bólu są urazy, czyli pojedyncze zdarzenia, w wyniku których doszło do uszkodzenia kolana oraz urazy z przeciążenia, czyli sytuacje, kiedy ból kolana jest wynikiem powtarzającego się nadwyrężania kolana, bez jednego uchwytnego dużego urazu.
Objaw może pojawić się nagle, najczęściej urazie lub wysiłku fizycznym. Może również rozpocząć się jako łagodny dyskomfort, a następnie powoli się nasilać.
Ból kolana – urazy i przeciążenia
Urazy kolana, które mogą skutkować bólem stawu mogą być spowodowane przez:
- nadwyrężenie (naciągnięcie) mięśni – sporty, zwłaszcza wymagające gwałtownego przyspieszania i zwalniania tempa aktywności (koszykówka, piłka nożna);
- uszkodzenia łąkotek – objawiające się głównie bólem z boku kolan, w zależności od lokalizacji uszkodzenia po stronie zewnętrznej lub wewnętrznej kolana;
- uszkodzenia więzadeł kolana – mogą powstawać w czasie uprawiania sportu, objawy związane z urazami więzadeł to ból, obrzęk oraz uczucie braku stabilności kolana;
- złamanie lub zwichnięcie rzepki;
- zespół bólu rzepkowo-udowego (tzw. kolano biegacza) – powszechny u sportowców;
- zapalenie ścięgien – powstające w wyniku przeciążenia tkanek nieprzygotowanych do wysiłku fizycznego;
- zapalenie kaletki – wynik powtarzającego się ucisku, np. długotrwałego klęczenia lub przeciążenia;
- choroba Osgood-Schlattera – aseptyczne zapalenie guzowatości kości piszczelowej (jałowa martwica guzowatości kości piszczelowej).
Ból kolana – choroby ogólnoustrojowe
Do chorób, które mogą być przyczyną bólu kolana należą:
- choroba zwyrodnieniowa stawów – obecny jest obustronny ból kolana;
- RZS – reumatoidalne zapalenie stawów to przewlekła choroba, objawiające się jako ból i obrzęk stawów, zwłaszcza dłoni, stóp, ale nie tylko. Zajęcie stawów jest często symetryczne; chorobę cechuje długa poranna sztywność stawów oraz objawy ogólnoustrojowe (zmęczenie, niewielka gorączka, nocne poty);
- toczeń rumieniowaty;
- dna moczanowa – choroba najczęściej dotyczy stawów dużego palca stopy, jednak ok. 30% pacjentów odczuwa objawy w stawie kolanowym, jest to artretyzm kolan, nazywany również gonagra. Napady dny moczanowej często pojawiają się w nocy lub nad ranem, widoczny jest obrzęk, zaczerwienienie i napięcie skóry, a okolica stawu jest wrażliwa na dotyk;
- reaktywne zapalenie stawów (choroba Reitera) – najczęściej (w ok. 2/3 przypadków) zajęty jest staw kolanowy, zmiany są obustronne i obecne są objawy ogólnoustrojowe. Największe nasilenie bólu obserwuje się w nocy;
- hemofilia – ból kolana pojawia się na skutek krwawienia do stawu. Objawy, które towarzyszą temu bólowi to obrzęk, ograniczona ruchomość stawu, a co za tym idzie problem z poruszaniem całą kończyną.
>> Sprawdź: Zespół Reitera (reaktywne zapalenie stawów) – objawy, przyczyny, badania i leczenie
Ból kolana – choroby infekcyjne
Ból kolana może również występować w przebiegu różnych infekcji. Należą do nich:
- borelioza stawowa – rozwija się co najmniej 6 miesięcy po ukłuciu przez kleszcza, średnio 1-2 lata po ekspozycji na Borrelia burgdorferi, a jedną z typowych lokalizacji tej choroby jest staw kolanowy. Borelioza stawowa jest schorzeniem, które nie prowadzi do destrukcyjnych zmian w stawie, jednak nierzadko po ustąpieniu procesu zapalnego mogą pozostawać ataki artralgii, czyli bólów stawowych, co powoduje, iż chory ma poczucie, że choroba nadal trwa.
- denga – tropikalna choroba wirusowa, w której charakterystyczne są dolegliwości stawowe. Jeśli zajęte jest kolano pacjenci poruszają się w typowy sposób, na usztywnionych nogach. Zapalenie stawów występujące u osób, które wróciły z tropików jest wskazówką do ukierunkowania diagnostyki w kierunku dengi.
- septyczne zapalenie stawów – wywoływane przez różne drobnoustroje, np. bakterie, wirusy, grzyby, prowadzi do obrzęku, bólu, zaczerwienienia. Wymaga szybkiego działania, ponieważ nieleczone, może prowadzić do rozległego uszkodzenia chrząstek kolana i destrukcji stawu.
Ból kolana – czynniki sprzyjające
Kolano jest stawem podlegających dużym obciążeniom, dlatego czynnikami, które sprzyjają występowaniu bólów tego stawu są:
- nadwaga lub otyłość – obciążają stawy kolanowe nawet podczas codziennych czynności, np. w czasie chodzenia, co zwiększa ryzyko uszkodzenia struktur stawowych i wystąpienia zmian zwyrodnieniowych;
- brak elastyczności lub siły mięśni – silne mięśnie pomagają stabilizować stawy, a elastyczność wspomaga sprawne działanie i prawidłowy zakres ruchu;
- niektóre rodzaje aktywności fizycznej – niektóre sporty lub zawody sprzyjają obciążaniu stawów kolanowych, np. narciarstwo alpejskie, koszykówka (szybkie zwroty), jogging;
- wcześniejsze urazy – wcześniejszy uraz kolana zwiększa prawdopodobieństwo ponownego urazu.
>> Może Cię zainteresować: Nadwaga a otyłość – czym się różnią? Klasyfikacja, leczenie i konsekwencje otyłości
Ból kolana – kiedy zgłosić się do lekarza?
Ból kolana nie zawsze jest groźny, czasem pomagają tzw. domowe sposoby leczenia. Jednak są sytuacje, gdy należy zgłosić się do lekarza.
Ból kolana powinien zaniepokoić, jeśli:
- występuje znaczny obrzęk, zaczerwienienie, gorączka,
- ból jest silny i powiązany z urazem,
- ból nie ustępuje, lub nasila się,
- towarzyszymy mu niestabilność kolana,
- ograniczony jest ruch w stawie – nie można go w pełni zgiąć lub wyprostować, nie można stanąć na jednej nodze,
- widoczna deformacja stawu kolanowego,
- wystąpi ból, obrzęk, drętwienie, zasinienie łydki poniżej bolącego kolana.
>> Warto sprawdzić też: Drętwienie nóg – o czym może świadczyć? Kiedy zgłosić się do lekarza?
Diagnostyka bólu kolan
Do jakiego lekarza należy iść z bólem kolana?
Ból kolana może być spowodowany różnymi przyczynami. Dlatego najlepiej zacząć od konsultacji z lekarzem rodzinnym, który pokieruje dalszą diagnostyką i skieruje do odpowiedniego specjalisty, np. reumatologia, ortopedy, czy lekarza chorób zakaźnych.
Jakie badania mogą być zalecone w celu ustalenia przyczyny bólu kolan?
Po przeprowadzeniu badania fizykalnego kolana i zebraniu wywiadu, lekarz może zlecić RTG, USG; rezonans magnetyczny (jeśli przyczyną może być uszkodzenie więzadła lub łąkotki), tomografię komputerową.
W przypadku podejrzenia infekcji lub stanu zapalnego należy wykonać badania krwi: morfologia, CRP, OB. Ponadto badania w kierunku boreliozy czy dengi.
Diagnozę dny moczanowej potwierdza podwyższony poziom kwasu moczowego, choroby autoimmunologiczne i reumatyczne będą wymagały badań takich jak:
- czynnik reumatoidalny, anty CCP – RZS,
- przeciwciała przeciwjądrowe – ANA – toczeń trzewny.
W określonych przypadkach – po pobraniu płynu stawowego – zleca się jego badanie i posiew.
>> Warto przeczytać: Morfologia krwi – co oznaczają wyniki i jak je odczytać?
Ból kolana – leczenie
Leczenie bólu kolana ściśle zależy od jego przyczyny. W niektórych przypadkach wystarczy postępowanie zachowawcze, czasem trzeba dołączyć leki.
Domowe sposoby na ból kolan
Czasem wystarczy powstrzymanie się od określonej aktywności i nieobciążanie kolana. Jeśli ból jest następstwem niewielkiego urazu można:
- stosować zimne okłady,
- unikać aktywności, która ból nasila,
- zastosować leki bez recepty, np. ibuprofen, naproksen, ketoprofen,
- zastosować maści lub kremy przeciwzapalne, przeciwbólowe,
- unosić kolana wyżej,
- spać z poduszką pomiędzy kolanami.
Postępowanie zachowawcze
W leczeniu bólu kolan czasem wskazane są odpowiednie ćwiczenia wzmacniające i rozciągające dobrane przez fizjoterapeutę. Często wskazane są zabiegi fizjoterapeutyczne.
W przypadku pacjentów otyłych lub z nadwagą, ważną rolę będzie odgrywać redukcja masy ciała.
| Warto wiedzieć: Każde dodatkowe 0,5 kilograma masy ciała powoduje około 2,25 kilograma dodatkowego nacisku na rzepki podczas wchodzenia i schodzenia po schodach. |
Leczenie bólu kolana
Leki stosowane w leczeniu bólu stawów zależą od przyczyny choroby. Jeśli przyczyną jest infekcja bakteryjna, wskazana jest antybiotykoterapia. O zastosowaniu odpowiedniego antybiotyku decyduje lekarz, często wskazówką jest badanie mikrobiologiczne płynu stawowego.
Jeśli przyczyną dolegliwości bólowych są choroby ogólnoustrojowe, np. dna moczanowa, choroby autoimmunologiczne, RZS, zasadnicze leczenie postępowanie polega na leczeniu choroby podstawowej.
W niektórych przypadkach lekarz może zasugerować podanie leków lub innych substancji bezpośrednio do stawu. Mogą to być:
- kortykosteroidy – zmniejszą objawy zapalenia stawów
- kwas hialuronowy – może poprawiać ruchomość stawu i łagodzić ból.
Jeśli przyczyną bólu jest uraz, może wymagać operacji.
>> Przeczytaj też: Antybiotyki – czy nadal są skuteczne?
Podsumowanie
Staw kolanowy to skomplikowana struktura, której uszkodzenie może być spowodowane przez wiele czynników. Dlatego, aby zachować kolana w jak najlepszym stanie należy pamiętać, aby:
- zawsze stosować rozgrzewkę przed treningiem i streching po treningu oraz poświęcić odpowiednią ilość czasu na regenerację
- utrzymywać prawidłową masę ciała
- stosować zdrową i zbilansowaną dietę
- zapewnić organizmowi optymalny poziom witaminy D.
Ból kolana – sekcja FAQ
Stan zapalny charakteryzuje się obrzękiem stawu, skóra może być ciepła i zaczerwieniona, pacjent może mieć kłopoty z poruszaniem, np. zginaniem i prostowaniem nogi w kolanie.
Antybiotyk w bólu kolana stosowany jest gdy jego przyczyną jest bakteryjne zapalenie stawów. Decyzję o rodzaju antybiotyku podejmuje lekarz. Gdy ból kolana spowodowany jest innymi chorobami, antybiotyki nie są skuteczne.
Ból kolana jest problemem wynikającym z wielu przyczyn i czynników, dlatego nie ma jednego składnika, który można uzupełnić, aby ta dolegliwość minęła. Należy dbać o prawidłową masę ciała i dostosowaną do stanu zdrowia aktywność fizyczną. Zdrowe stawy kolanowe to również zbilansowana dieta, zapewniająca optymalny poziom produkcji kolagenu w organizmie, w tym witaminy C, wapnia, magnezu, żelaza. Ponadto witaminy K. Należy również dbać o poziom witaminy D w organizmie, robiąc odpowiednie badania i stosując dostoswaną suplementację.
Jest możliwe, że silne dolegliwości kręgosłupa, zwłaszcza w odcinku lędźwiowym czy krzyżowym, mogą promieniować do kończyn dolnych.
Tak, ból kolana może mieć podłoże nerwowe, wynikające z ucisku korzeni nerwowych kręgosłupa, uwięźnięcia nerwu kulszowego lub zaburzeń w układzie nerwowym. Często objawia się to bólem promieniującym do uda lub łydki.
Bibliografia
- Pagana K., Pagana T., Testy laboratoryjne i badania diagnostyczne w medycynie, Elsevier Urban&Partner, Wrocław, 2013. s.46-47.
- Bochenek A., Reicher M., Anatomia Człowieka, tom I, Anatomia ogólna. Kości, stawy i więzadła. Mięśnie. PZWL Warszawa 1989. s. 587-600.
- Knee pain: MedlinePlus Medical Encyclopedia [dostęp: 1.12.2025 r.].
- Knee pain – Symptoms and causes – Mayo Clinic [dostęp: 1.12.2025 r.].
- Strukow A., Borelioza stawowa (boreliozowe zapalenie stawów) – objawy, leczenie; https://www.alab.pl/centrum-wiedzy/borelioza-stawowa-boreliozowe-zapalenie-stawow-objawy-leczenie-jakie-badania-wykonac/, [dostęp 10.11.2025 r.].
- Strukow A., Dna moczanowa: objawy, przyczyny, badania i leczenie podagry; https://www.alab.pl/centrum-wiedzy/dna-moczanowa-artretyzm/; [dostęp 10.11.2025 r.].
- Matusiak D., Zespół Reitera (reaktywne zapalenie stawów) – objawy, przyczyny, badania i leczenie; https://www.alab.pl/centrum-wiedzy/zespol-reitera-reaktywne-zapalenie-stawow-objawy-przyczyny-badania-i-leczenie/; [dostęp 10.11.2025 r.].
- Fiałek B., Czym jest RZS? Jak często występuje, kogo dotyka?; https://www.alab.pl/centrum-wiedzy/czym-jest-rzs-jak-czesto-wystepuje-kogo-dotyka/; [dostęp 10.11.2025].
- Strukow A., Denga – wirusowa choroba tropikalna; https://www.alab.pl/centrum-wiedzy/denga-wirusowa-choroba-tropikalna/; [dostęp 10.11.2025 r.].
- https://remedium.md/icd10; [dostęp 10.11.2025 r.].