Stopa cukrzycowa jest poważnym powikłaniem cukrzycy. Prowadzi do wystąpienia nieprzyjemnych dolegliwości, obniżenia jakości życia chorego, niepełnosprawności, a w skrajnych przypadkach do amputacji kończyny. Dlatego bardzo ważne jest jej wczesne rozpoznanie oraz wdrożenie odpowiednich działań terapeutycznych i profilaktycznych. Zobacz, co to jest stopa cukrzycowa, jak wygląda i jakie są jej objawy.
Spis treści:
- Czym jest stopa cukrzycowa?
- Rodzaje stopy cukrzycowej
- Stopa cukrzycowa: jak wygląda?
- Przyczyny rozwoju stopy cukrzycowej
- Stopa cukrzycowa. Pierwsze objawy zespołu stopy cukrzycowej
- Późniejsze objawy stopy cukrzycowej
- Diagnostyka stopy cukrzycowej: jakie badania wykonać?
- Jak leczyć osoby ze stopą cukrzycową?
- Czy można zapobiec rozwojowi stopy cukrzycowej?
- Stopa cukrzycowa. Najczęstsze pytania (FAQ)
- Co to jest stopa cukrzycowa? Podsumowanie informacji
Czym jest stopa cukrzycowa?
Stopę cukrzycową definiuje się jako infekcję, owrzodzenie i/lub destrukcję głębokich tkanek stopy występującą u osoby chorej na cukrzycę, która jest spowodowana uszkodzeniem nerwów obwodowych i/lub naczyń krwionośnych kończyn dolnych. Zmiany chorobowe mogą obejmować skórę, kości, mięśnie, naczynia krwionośne, nerwy.
Stopa cukrzycowa najczęściej pojawia się po wielu latach od zachorowania na cukrzycę. Rzadko zdarza się, że u osób niezdiagnozowanych lub nieleczonych jest jej pierwszym objawem.
W Międzynarodowej Klasyfikacji Chorób ICD-10 stopa cukrzycowa nie ma jednego symbolu. Kod użyty przez personel medyczny zależy do rodzaju cukrzycy oraz rodzaju powikłań (np. E11.5 – cukrzyca insulinoniezależna z powikłaniami w zakresie krążenia obwodowego).
| Warto wiedzieć: W 2023 roku Międzynarodowa Grupa Robocza ds. Stopy Cukrzycowej zaproponowała nową, rozszerzoną definicję i nazwę dla stopy cukrzycowej. Zgodnie ze zmianami cukrzycowa choroba stopy obejmuje neuropatię obwodową, chorobę tętnic obwodowych, infekcję, owrzodzenie, osteoartropatię, gangrenę lub amputację. Jest ona stopniowo wdrażana. |
Stopa cukrzycowa a „palec cukrzycowy”: czym się różnią?
„Palec cukrzycowy” jest potocznym określeniem na jedną z możliwych lokalizacji zmian w przebiegu stopy cukrzycowej. Termin nie istnieje w terminologii medycznej.
Zmiany skórne odpowiadające owrzodzeniom i martwicy w przebiegu stopy cukrzycowej bardzo często lokalizują się właśnie na palcach stóp – zwłaszcza na opuszkach i powierzchniach grzbietowych, które są uszkadzane mechanicznie przez obuwie. Jest to szczególnie niebezpieczne ze względu na utrudnione gojenie ran w przypadku współwystępowania niedokrwienia.
>> Przeczytaj: Im wcześniej, tym lepiej – jak nowoczesna diagnostyka i leki mogą zmienić przebieg cukrzycy
Rodzaje stopy cukrzycowej
Stopę cukrzycową dzieli się na neuropatyczną, naczyniową (niedokrwienną), mieszaną.
Neuropatyczna stopa cukrzycowa
Neuropatyczna stopa cukrzycowa jest najczęstszą postacią i dotyczy 45-60% przypadków. Przyczyną jest uszkodzenie nerwów czuciowych i ruchowych. W efekcie dochodzi do zmniejszenia lub utraty czucia bólu, temperatury i dotyku w stopie. Następuje również wzrost przepływu krwi, dlatego neuropatyczna stopa cukrzycowa jest zaczerwieniona i ciepła.
Niedokrwienna stopa cukrzycowa
Niedokrwienna stopa cukrzycowa jest skutkiem zmian miażdżycowych i zniszczenia naczyń włosowatych w stopie. Niedotlenione i pozbawione składników odżywczych tkanki stają się podatne na uszkodzenia, a powstałe rany nie goją się. Stopa jest chłodna, a na tętnicy grzbietowej i odpiszczelowej nie można wyczuć tętna.
Formy mieszane stopy cukrzycowej
Mieszana stopa cukrzycowa dotyczy 25-30% przypadków. W tej postaci występują zarówno objawy uszkodzenia nerwów, jak i niedokrwienia, przez co znacznie wzrasta ryzyko powikłań.
>> To może Cię zainteresować: Cukrzyca u dzieci i młodzieży
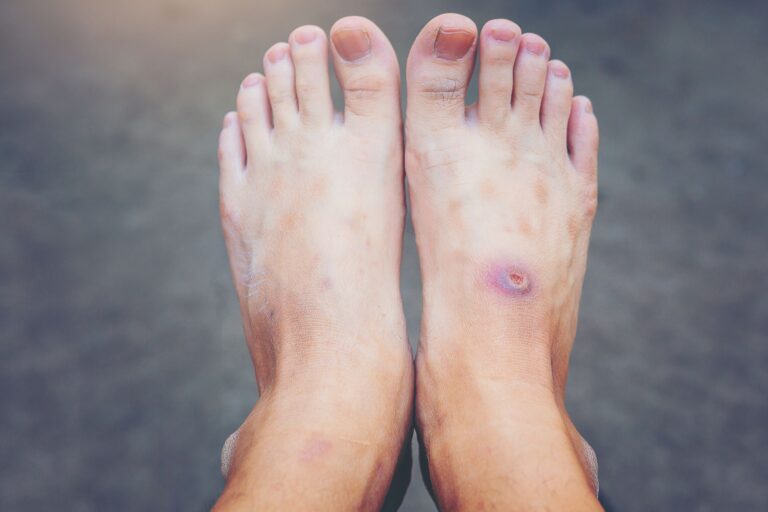
Stopa cukrzycowa: jak wygląda?
Wygląd zależy od rodzaju i stopnia zaawansowania zmian. Neuropatyczna stopa cukrzycowa jest zaróżowiona. Mogą na niej występować obrzęk, owrzodzenia, modzele, martwica. U części chorych obecne są zmiany w stawach (np. przemieszczenie) spowodowane ograniczeniem ich ruchomości w wyniku neuropatii (osteoartropatia Charcota).
Niedokrwienna stopa cukrzycowa jest blada, zimna, z suchą, cienką i napiętą skórą pozbawioną owłosienia. Mogą na niej występować bolesne owrzodzenia – zlokalizowane głównie na brzegach stopy, pięcie i palcach.
>> Zobacz: Opuchnięte nogi i kostki. Możliwe przyczyny opuchlizny nóg
Przyczyny rozwoju stopy cukrzycowej
Główną przyczyną stopy cukrzycowej jest przewlekła hiperglikemia, która uszkadza naczynia krwionośne i nerwy. Najważniejsze czynniki ryzyka to:
- wieloletnia i źle prowadzona cukrzyca,
- zmiany miażdżycowe,
- neuropatia,
- obecność zniekształceń stopy,
- noszenie źle dopasowanego obuwia,
- nierównomiernie rozłożony nacisk na stopę,
- palenie tytoniu,
- modzele,
- deformacje stóp,
- nieodpowiednia pielęgnacja stóp.
Szacuje się, że stopa cukrzycowa występuje u 10% chorych na cukrzycę.
Stopa cukrzycowa. Pierwsze objawy zespołu stopy cukrzycowej
Pierwsze objawy stopy cukrzycowej to:
- uczucie mrowienia, palenia lub pieczenia palców,
- nadwrażliwość na dotyk lub stopniowe osłabienie czucia,
- zimne lub nadmierne ucieplone palce,
- suchość i utrata elastyczności skóry stóp,
- drętwienie lub bóle stóp.
Występowanie któregokolwiek z objawów u osoby chorej na cukrzycę jest wskazaniem do konsultacji lekarskiej.
>> Przeczytaj: Śpiączka cukrzycowa: objawy, rodzaje, przyczyny i pierwsza pomoc
Późniejsze objawy stopy cukrzycowej
W miarę postępu stopy cukrzycowej pojawiają się trudno gojące się rany i owrzodzenia, które mogą penetrować głęboko aż do kości. Często obecne są także deformacje kości i stawów, przewlekłe infekcje, a w skrajnych sytuacjach martwica tkanek wymagająca interwencji chirurgicznej.
| Pamiętaj: W ocenie stopnia zaawansowania stopy cukrzycowej stosuje się klasyfikację PEDIS, która ocenia ukrwienie, zasięg i wielkość zmiany, głębokość zmiany, nasilenie infekcji oraz czucie. |
Diagnostyka stopy cukrzycowej: jakie badania wykonać?
Diagnostyka stopy cukrzycowej opiera się o wywiad medyczny oraz badanie przedmiotowe, w którym oceniane są:
- kolor i ucieplenie skóry stóp,
- kształt i ruchomość w stawie,
- obecność ewentualnych deformacji i hiperkeratoz,
- stan paznokci,
- czucie dotyku,
- czucie ucisku (z użyciem monofilamentu Semmesa-Weinsteina),
- czucie wibracji (z użyciem kamertonu),
- czucie bólu (z użyciem neurotipu),
- czucie temperatury,
- stan naczyń krwionośnych (palpacyjnie i podczas USG Dopplera).
W razie potrzeby lekarz może zlecić również badania obrazowe oraz testy laboratoryjne z krwi (m.in. poziom glukozy na czczo, hemoglobinę glikowaną, markery stanu zapalnego, w tym stężenie białka CRP i poziom prokalcytoniny).

W przypadku podejrzenia infekcji w obrębie owrzodzenia lekarz może zadecydować o konieczności wykonania wymazu i posiewu z rany. Takie badanie pozwoli na identyfikację drobnoustroju w przypadku współistnienia infekcji, a także na określenie jego lekowrażliwości.
Jak leczyć osoby ze stopą cukrzycową?
Leczenie stopy cukrzycowej dopasowywane jest do rodzaju i stopnia zaawansowania. W terapii zastosowanie mają m.in.:
- odciążenie kończyny,
- antybiotykoterapia (w przypadku infekcji),
- specjalistyczne opatrunki,
- opracowywanie ran,
- zabiegi podologiczne,
- zabiegi chirurgiczne i operacje naczyniowe,
- komora hiperbaryczna i leczenie ran podciśnieniem,
- leki poprawiające ukrwienie,
- przeszczep skóry.
Leczenie stopy cukrzycowej jest długotrwałym procesem, który wymaga interdyscyplinarnego podejścia z udziałem diabetologa, chirurga naczyniowego, ortopedy, podologa, specjalisty leczenia ran. Obowiązkowym elementem terapii jest wyrównanie glikemii, bez którego nie jest możliwe osiągnięcie oczekiwanych efektów.
Powikłania nieleczonej stopy cukrzycowej
Nieleczona stopa cukrzycowa prowadzi do poważnych powikłań. Są to rozległe owrzodzenia, przewlekłe infekcje, wstrząs septyczny, a także martwica, która często skutkuje amputacją kończyny.
>> Sprawdź: Martwica – jak do niej dochodzi? Objawy, przyczyny, rodzaje martwicy tkanek
Czy można zapobiec rozwojowi stopy cukrzycowej?
Profilaktyka stopy cukrzycowej obejmuje:
- wyrównanie poziomu glukozy we krwi,
- codzienną samokontrolę stóp,
- badanie stóp u lekarza lub podologa (raz w roku lub częściej, jeżeli zostały stwierdzone nieprawidłowości),
- regularne zabiegi podologiczne,
- dobór odpowiedniego obuwia i wkładek ortopedycznych,
- eliminację czynników ryzyka.
Działania profilaktyczne powinny być dostosowane indywidualnie po wcześniejszej ocenie ryzyka stopy cukrzycowej.
Stopa cukrzycowa. Najczęstsze pytania (FAQ)
Odpowiedzi na najczęściej zadawane pytania dotyczące stopy cukrzycowej.
W przypadku neuropatii stopa jest ciepła, różowa, z widocznymi modzelami i deformacjami. Przy niedokrwieniu stopa jest zimna, blada lub sina, z skórą cienką i błyszczącą. Mogą pojawić się owrzodzenia, trudno gojące się rany i martwica.
5-letnia śmiertelność u osoby z rozpoznaną stopą cukrzycową wynosi 50%.
Co to jest stopa cukrzycowa? Podsumowanie informacji
- Stopa cukrzycowa to poważne powikłanie cukrzycy obejmujące infekcje, owrzodzenia i destrukcję tkanek stopy.
- Wyróżnia się trzy postacie stopy cukrzycowej: neuropatyczną, niedokrwienną oraz mieszaną.
- Pierwsze objawy stopy cukrzycowej to m.in. zaburzenia czucia, suchość i zblednięcie skóry. Następnie pojawiają się owrzodzenia, trudno gojące się rany oraz martwica. Brak leczenia może prowadzić do amputacji kończyny.
Opieka merytoryczna: lek. Katarzyna Banaszczyk
Bibliografia
- Stanowisko Polskiego Towarzystwa Diabetologicznego, Zalecenia kliniczne dotyczące postępowania u osób z cukrzycą – 2024
- E. Drela, G. Mielcarz, Zespół stopy cukrzycowej niedokrwiennej – od epidemiologii do diagnostyki, Pielęgniarstwo Chirurgiczne i Angiologiczne 2017; 11 (3): 73–77
- https://podyplomie.pl/diabetologia/26180,zespol-stopy-cukrzycowej-praktyczne-porady (dostęp 05.09.2025)
- IWGDF Guidelines on the prevention and management of diabetes-related foot disease 2023
- M. Korzonek i in., Zespół stopy cukrzycowej – problem wciąż aktualny, Pielęgniarstwo Chirurgiczne i Angiologiczne 2016; 1: 1–8
- https://ptlr.org/wp-content/uploads/2022/05/Wytyczne-ZSC-czesc-1.pdf (dostęp 05.09.2025)
- https://ptlr.org/wp-content/uploads/2022/05/Wytyczne-ZSC-czesc-2.pdf (dostęp 05.09.2025)