Zespół Cushinga to zestaw objawów klinicznych spowodowanych nadmiernym wydzielaniem przez organizm kortyzolu (hormonu stresu) lub glikokortykosteroidami podawanymi pacjentom w czasie leczenia różnych chorób. Co się dzieje, gdy organizm nie radzi sobie z nadmiarem kortyzolu? Jakie są objawy zespołu Cushinga, jak można chorobę zdiagnozować i jak leczyć? Odpowiedzi na te pytania znajdziecie w artykule.
Spis treści:
- Jakie są przyczyny zespołu Cushinga?
- Zespół Cushinga – objawy somatyczne
- Zespół Cushinga – obraz kliniczny
- Jakie badania na zespół Cushinga?
- Zespół Cushinga – leczenie i rokowanie
- Zespół Cushinga – podsumowanie
Jakie są przyczyny zespołu Cushinga?
Zespół Cushinga to zespół objawów klinicznych wynikających z nadmiaru hormonów glikokortykosteroidowych.
Zespół Cushinga może być wywołany przez:
- nadmierną produkcję hormonów w organizmie człowieka – postać endogenna;
- podawanie syntetycznych hormonów w przebiegu leczenia różnych chorób, np. reumatoidalnego zapalenia stawów lub miastenii – postać egzogenna, nazywana również jatrogennym zespołem Cushinga.
>> Sprawdź też: Miastenia – choroba zmęczonych mięśni oraz Czym jest RZS, jak często występuje, kogo dotyka?
Endogenny zespół Cushinga spotykany jest rzadziej niż postać zespołu spowodowana podawaniem sterydów. Jego przyczynami mogą być:
- guz przysadki mózgowej (mikrogruczolak, makrogruczolak) powodujący nadmierne wydzielanie ACTH – hormonu stymulującego produkcję kortyzolu w nadnerczach;
- ektopowe wydzielanie ACTH – guz produkujący hormon umiejscowiony jest poza przysadką mózgową;
- guz nadnerczy (gruczolak, rak) wydzielający nadmierne ilości kortyzolu.
Choroba Cushinga a zespół Cushinga – czym się różnią?
Funkcjonujące w medycynie pojęcia zespół Cushinga i choroba Cushinga nie są określeniem tego samego stanu.
Zespół Cushinga jest pojęciem szerszym i obejmuje cały zestaw objawów spowodowanych przez nadmierną podaż kortyzolu, niezależnie od tego jakie są jego przyczyny. Choroba Cushinga jest natomiast postacią zespołu Cushinga spowodowaną przez występowanie wydzielającego ACTH gruczolaka przysadki. Choroba Cushinga to ok. 80% wszystkich przypadków zespołu Cushinga.

>>> Przeczytaj też: Kortyzol – hormon stresu
Zespół Cushinga – objawy somatyczne
Klasyczne objawy somatyczne zespołu Cushinga to:
- otyłość centralna,
- zaokrąglenie i zaczerwienienie twarzy,
- zanik mięśni,
- czerwonosine rozstępy skóry.
Zespół Cushinga – sylwetka
Otyłość centralna i specyficzne rozłożenie tkanki tłuszczowej powoduje, iż sylwetka pacjenta z zespołem Cushinga jest charakterystyczna.
Tkanka tłuszczowa zaczyna gromadzić się w dołach nadobojczykowych – jest to najwcześniejszy objaw zespołu. Ponadto odkłada się na karku (powodując tzw. bawoli kark lub byczy kark), na twarzy i na brzuchu (dając obraz zwisającego brzucha).
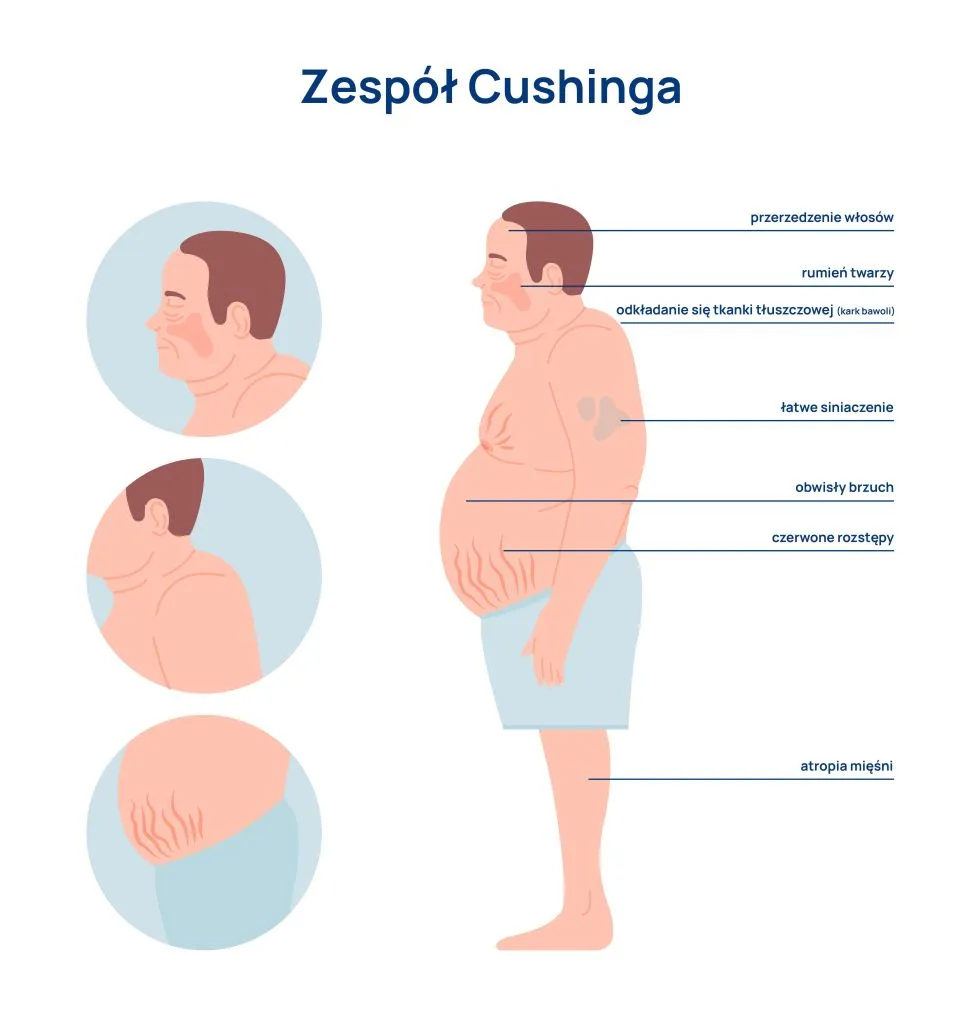
U chorego z zespołem Cushinga tkanka tłuszczowa nie gromadzi się na kończynach górnych i dolnych oraz na pośladkach, szczupłość tych partii ciała kontrastuje z tkanką tłuszczową zgromadzoną w częściach centralnych.
Zespół Cushinga – twarz księżycowata
Zgromadzenie tkanki tłuszczowej na twarzy (skronie, boki twarzy, podbródek) powoduje jej zaokrąglenie, dając efekt twarzy księżycowatej. Inną charakterystyczną cechą jest zaczerwienienie twarzy występujące na policzkach, spowodowane rozszerzeniem naczyń krwionośnych skóry.
Zespół Cushinga – zanik mięśni szkieletowych
Zmiany w mięśniach szkieletowych spowodowane są nasileniem katabolizmu białek (efekt działania kortyzolu). Następuje zanik mięśni, który dotyczy obręczy barkowej i biodrowej, a pacjent odczuwa osłabienie tych mięśni. Zanik mięśni kończyn również przyczynia się do powstawania efektu charakterystycznej sylwetki.
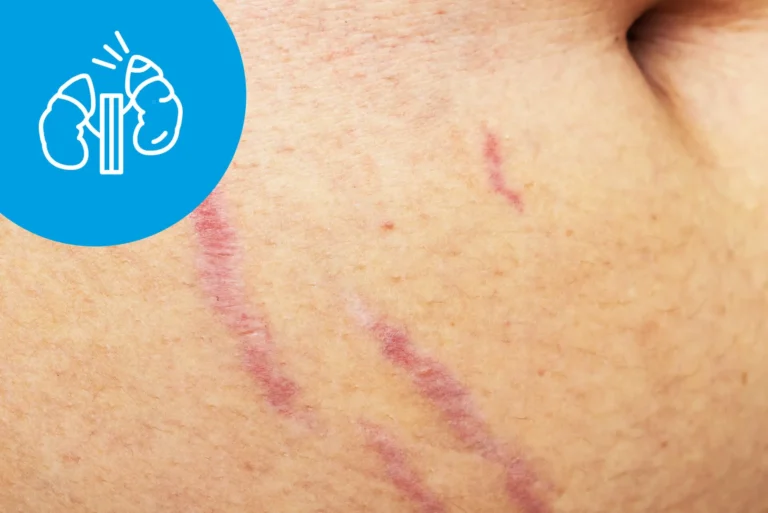
Zespół Cushinga – rozstępy
Charakterystyczną cechą zespołu Cushinga są sinoczerwone rozstępy skórne, będące wynikiem pękania włókien sprężystych i powodujące powstawanie trwałych blizn. Rozstępy występują najczęściej na brzuchu i na biodrach. U osób młodych mogą pojawiać się na udach, w dołach podkolanowych, pachowych i łokciowych, na piersiach i na pośladkach.
Rozstępy w zespole Cushinga w fazie aktywnej hiperkortyzolemii mają charakterystyczne sinoczerwone zabarwienie, ustępuje ono po wyrównaniu stężenia tego hormonu. Barwa rozstępów pomaga je różnicować z rozstępami powstającymi wskutek otyłości prostej (są wówczas białe) lub z rozstępami powstającymi wskutek szybkiego przyrostu masy ciała u dzieci (są barwy różowej).

Zespół Cushinga – obraz kliniczny
Klasyczne objawy kliniczne zespołu Cushinga obejmują wiele symptomów i dotykają wiele obszarów ciała. W efekcie pacjent szuka pomocy u wielu lekarzy specjalistów (jeśli pojawia się trądzik, odwiedza dermatologa, jeśli brak miesiączki, odwiedza ginekologa lub endokrynologa, jeśli tyje, odwiedza dietetyka), co opóźnia postawienie diagnozy i skuteczne (przyczynowe) leczenie.
W zespole Cushinga występują cztery objawy kliniczne, których współwystępowanie uważa się za patognomiczne, czyli swoiste, dla zespołu Cushinga. Występowanie objawów patognomicznych w obrazie klinicznym często wystarcza do rozpoznania danej choroby. Są to:
- otyłość centralna,
- zaniki mięśni,
- nadciśnienie tętnicze,
- skłonność do powstawania siniaków.
>>> Przeczytaj też: Nadciśnienie tętnicze – nowe rekomendacje – część 1
Pozostałe symptomy zespołu Cushinga to:
- objawy ogólne – osłabienie, zła tolerancja wysiłku;
- objawy z układu płciowego – skąpe miesiączki, zanik miesiączki, zaburzenia libido, zaburzenia erekcji;
- objawy skórne – oprócz rozstępów pacjent skarży się na ścieńczenie skóry, łatwe powstawanie urażeń i siniaków, trądzik, przetłuszczająca się skóra, nadmierne owłosienie;
- objawy ze strony układu krążenia – nadciśnienie tętnicze, niewydolność serca, skłonność do powstawania zakrzepów żylnych;
- objawy psychiczne – zaburzenia nastroju, zaburzenia snu, depresja, euforia;
- objawy ze strony układu kostnego – osteoporoza (występuje u ok. 80% pacjentów);
- zaburzenia metaboliczne – upośledzenie tolerancji glukozy, cukrzyca;
- zaburzenia odporności – ciężkie zakażenia bakteryjne, zakażenia grzybicze skóry, paznokci i błon śluzowych.
>>> Przeczytaj też: Cukrzyca epidemią XXI wieku
Jakie badania na zespół Cushinga?
Badania w zespole Cushinga obejmują badania laboratoryjne, wśród nich badania hormonalne oraz badania obrazowe:
- ogólne badania analityczne – ponieważ zespół Cushinga powoduje szereg zaburzeń metabolicznych, wykonuje się następujące badania z krwi: poziom sodu i potasu, glukoza na czczo, krzywa cukrowa, hemoglobina glikowana, morfologia;
- badania hormonalne – stężenie androstednionu, DHEA-S, testosteronu, ACTH, stężenie kortyzolu (w surowicy, w ślinie, ocena rytmu dobowego wydzielania kortyzolu w ślinie);
- test hamowania deksametazonem – pozwala odróżnić zespół Cushinga od otyłości prostej, PCOS – zespołu policystycznych jajników oraz zespołu metabolicznego spowodowanego innymi niż hiperkortyzolemia przyczynami. Test polega na doustnym podaniu 1 mg deksametazonu w późnych godzinach wieczornych (godz. 22.00 lub 23.00), i oznaczeniu stężenia kortyzolu w godzinach porannych (godz. 8.00 lub 9.00) dnia następnego. Na zespół Cushinga wskazuje podwyższony poziom kortyzolu w teście hamowania;
- badania obrazowe – rezonans magnetyczny głowy (przy podejrzeniu choroby Cushinga), tomografia komputerowa jamy brzusznej (przy podejrzeniu guzów nadnerczy), densytometria (diagnostyka osteoporozy).
>> Przeczytaj też: Jak zbadać poziom kortyzolu? Badanie kortyzolu z krwi, śliny i moczu – różnice
Zespół Cushinga – leczenie i rokowanie
Leczenie zespołu Cushinga zależy od jego przyczyny. Gruczolaki przysadki (choroba Cushinga) oraz guzy nadnerczy leczy się operacyjnie. W leczeniu raka nadnerczy wykorzystuje się chemioterapię.
Nieleczona lub nieskutecznie leczona choroba daje złe rokowania. Śmiertelność w zespole Cushinga wynosi 50% w ciągu 5 lat. Natomiast operacyjne usunięcie hormonalnie czynnego guza nadnerczy i gruczolaka przysadki powoduje ustąpienie objawów somatycznych i cofnięcie się zaburzeń metabolicznych. Powodzenie w leczeniu raka nadnerczy zależy od stopnia zaawansowania choroby w momencie jej rozpoznania.
Zespół Cushinga – podsumowanie
Zespół Cushinga to specyficzny zespół objawów klinicznych i somatycznych, które mogą mieć różne przyczyny. Nieleczony zespół Cushinga jest stanem zagrażającym życiu, dlatego tak ważna jest wczesna i ukierunkowana diagnostyka, znalezienie przyczyny, skuteczna terapia i monitorowanie stanu chorego.
Bibliografia:
Wielka Interna, Endokrynologia, pod redakcją Wojciecha Zgliczyńskiego. Medical Tribune Polska, Warszawa 2020. Wydanie II.