Rogowacenie słoneczne to często występujące schorzenie dermatologiczne, które związane jest z ryzykiem przekształcenia do raka kolczystokomórkowego skóry. Jak objawia się rogowacenie słoneczne i jakie są jego przyczyny? Przeczytaj poniższy artykuł i dowiedz się więcej na temat rogowacenia słonecznego.
Spis treści:
- Co to jest rogowacenie słoneczne?
- Przyczyny rogowacenia słonecznego
- Objawy rogowacenia słonecznego
- Jak leczyć rogowacenie słoneczne?
- Jak zapobiec rogowaceniu słonecznemu?
- FAQ. Rogowacenie słoneczne – często zadawane pytania
- Rogowacenie słoneczne – podsumowanie
Co to jest rogowacenie słoneczne?
Rogowacenie słoneczne, nazywane również rogowaceniem starczym, uznawane jest aktualnie za raka in situ, a więc nowotwór złośliwy skóry nieprzekraczający błony podstawnej.
Błona podstawna to granica pomiędzy naskórkiem, będącym najbardziej zewnętrzną warstwą skóry, a położoną głębiej skórą właściwą. Oznacza to, że w przypadku rogowacenia słonecznego zmienione, nieprawidłowe komórki nie dostają się do skóry właściwej. Jeżeli do tego dojdzie, wówczas mówi się już o raku kolczystokomórkowym skóry (SCC). Ryzyko transformacji rogowacenia słonecznego do raka kolczystokomórkowego skóry to około 10% w ciągu 10 lat.
W dermatologii wyróżnia się kilka postaci histologicznych rogowacenia słonecznego, a mianowicie:
- postać hipertroficzną,
- postać akantolityczną,
- postać atroficzną,
- postać bowenoidalną,
- postać barwnikową,
- postać liszajowatą.
>> Zobacz: Liszaj twardzinowy: objawy, przyczyny i leczenie
Przyczyny rogowacenia słonecznego
Rogowacenie słoneczne (keratosis actinica) jest spowodowane długotrwałą, przewlekłą ekspozycją na promieniowanie ultrafioletowe (przede wszystkim UVB). Promieniowanie ultrafioletowe prowadzi do zmian w materialne genetycznym komórek naskórka (a więc w DNA, tj. kwasie deoksyrybonukleinowym), pojawienia się mutacji genetycznych, ale również prowadzi do stanu immunosupresji. Konsekwencją tych zmian są pojawiające się stopniowo niekontrolowane podziały komórek naskórka.
>>Badanie witaminy D to badanie krwi, które pozwala ocenić poziom tej witaminy. Wykonasz je w ALAB laboratoria:<<

Rogowacenie słoneczne istotnie częściej pojawia się u osób starszych (powyżej 60-65. roku życia), ponieważ skóra tych osób przez wiele lat była eksponowana na promieniowanie ultrafioletowe.
>> Sprawdź: Wpływ promieni słonecznych na skórę
Czynniki ryzyka związane z występowania rogowacenia słonecznego to między innymi:
- jasny fototyp (I i II) – jasna cera, skłonna do poparzeń słonecznych,
- zamieszkiwanie rejonów okołorównikowych,
- płeć męska,
- narażenie na arsen,
- czynniki genetyczne – zespoły genetyczne, cechujące się dużym ryzykiem nowotworów złośliwych skóry, na przykład xeroderma pigmentosum,
- albinizm,
- stan po transplantacjach narządów,
- przyjmowanie leków immunosupresyjnych, a więc wyciszających układ immunologiczny.
>> To może Cię zainteresować: Choroba Bowena – czym jest i jakie daje objawy? Przyczyny i leczenie
Objawy rogowacenia słonecznego
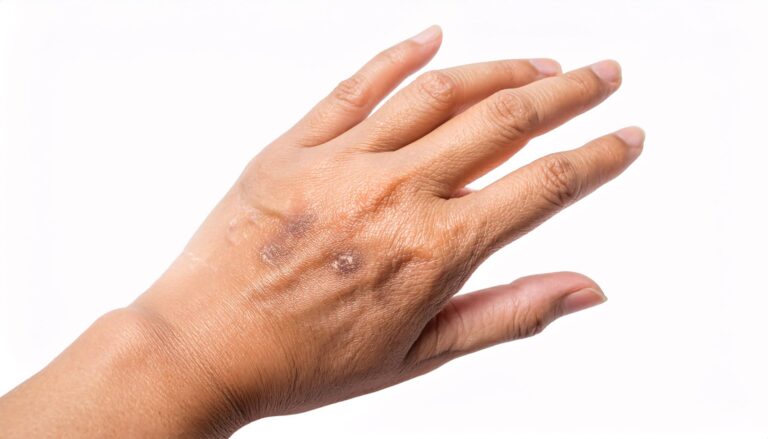
Rogowacenie słoneczne występuje pod postacią zmian owalnych, typowo rumieniowych, pojedynczych lub mnogich, które pokryte są łuską. Sprawia to, że wykwity te są szorstkie podczas palpacji skóry. Zmiany chorobowe lokalizują się najczęściej na powierzchniach odsłoniętych, a więc na skórze twarzy, szyi, czy grzbietach rąk.
Cechy, które budzą niepokój onkologiczny i sprawiają, że należy brać pod uwagę transformację do raka kolczystokomórkowego to przede wszystkim:
- nacieczenie zmiany u podstawy,
- pojawienie się na powierzchni zmiany owrzodzenia,
- pojawienie się wokół zmiany rąbka zapalnego.
Warto wiedzieć, że zmiana nazywana w dermatologii rogiem skórnym również jest zaliczana do rogowacenia słonecznego. Jest to twardy twór, zbudowany z białka keratyny, który przyjmuje kształt lekko zagiętego, stożkowatego rogu. Róg skórny lokalizuje się najczęściej na skórze twarzy.
Rogowacenie słoneczne: kategorie KIN
Zmiany występujące w przebiegu rogowacenia słonecznego zalicza się do trzech kategorii KIN (z ang. keratotic intraepithelial neoplasia). Wyróżniamy:
- KIN1 – jest to najwcześniejszy rodzaj zmian w przebiegu rogowacenia słonecznego, w tym przypadku zmiany skórne nie wykazują szorstkości, a histopatologicznie komórki naskórka (keratynocyty) wykazują tylko niewielkie nieprawidłowości i nie różnią się istotnie od prawidłowych keratynocytów,
- KIN2 – w tym przypadku najczęściej pojawia się już wyczuwalna palpacyjnie szorstkość, z zmiany histopatologiczne komórek uwidaczniają się przede wszystkim w obrębie dolnych warstw naskórka,
- KIN3 – są to najbardziej zaawansowane zmiany, klinicznie często mają postać strupów, z kolei pod kątem histopatologicznym, nieprawidłowe komórki są obserwowane na całej grubości naskórka.
W potwierdzeniu rozpoznania rogowacenia słonecznego niezwykle ważną rolę odgrywa badanie dermatoskopowe. Warto wspomnieć, że w diagnostyce różnicowej rogowacenia słonecznego bierze się pod uwagę takie schorzenia dermatologiczne jak:
- brodawka łojotokowa,
- rogowacenie arsenowe,
- podostra skórna postać tocznia rumieniowatego układowego (SCLE).
>> To może Cię zainteresować: Rumień wielopostaciowy: objawy, przyczyny i leczenie
Jak leczyć rogowacenie słoneczne?
W terapii rogowacenia słonecznego wykorzystuje się zarówno metody zachowawcze (farmakologiczne), jak i zabiegowe. Aktualnie dermatolodzy dysponują szerokim wachlarzem terapeutycznym rogowacenia słonecznego. Najczęściej zastosowanie znajdują takie substancje i procedury medyczne jak:
- 5% imikwimod w postaci kremu – preparat ten aplikuje się na zmiany chorobowe dwa, trzy razy w tygodniu, przez około miesiąc, krem stosuje się na noc i powinien on pozostawać na skórze przez około 8 godzin, po czym należy go zmyć,
- 5-fluorouracyl w postaci maści – preparat ten stosuje się dwa razy dziennie przez około 2-4 tygodnie,
- diklofenak w postaci żelu – lek ten aplikuje się na miejsca zmienione chorobowo dwa razy dziennie, a czas leczenia powinien wynosić 1-2 miesiące.
- miejscowe retinoidy,
- krioterapia – a więc potocznie mówiąc wymrażanie zmian skórnych,
- laseroterapia – na przykład z wykorzystaniem lasera CO2,
- terapia fotodynamiczna – najczęściej z zastosowaniem kwasu 5-aminolewulinowego,
- w niektórych przypadkach konieczne może być usunięcie chirurgiczne.
>> Sprawdź: Choroby skóry u człowieka. Najczęściej występujące dermatozy
Domowe sposoby na rogowacenie słoneczne
W związku z ryzykiem transformacji nowotworowej, rogowacenie słoneczne powinno być odpowiednio leczone pod okiem lekarza dermatologa. Domowe sposoby nie będą skuteczne w terapii rogowacenia słonecznego. Konieczne jest leczenie, które przeprowadza się pod okiem lekarza. O terapii rogowacenia słonecznego więcej można przeczytać w kolejnych akapitach tego artykułu.
Jak zapobiec rogowaceniu słonecznemu?
Najważniejszym krokiem w profilaktyce rogowacenie słonecznego jest unikanie ekspozycji na promieniowanie ultrafioletowe. Należy stosować kremy z filtrem, minimum SPF 50, a także unikać przebywania w pełnym słońcu, szczególnie między godziną 11:00 a 15:00. Warto również pamiętać o noszeniu czapki z daszkiem lub kapelusza z szerokim rondem.
>> Przeczytaj: Uczulenie na słońce (fotodermatoza): objawy, przyczyny, leczenie
FAQ. Rogowacenie słoneczne – często zadawane pytania
Omawiany w tym artykule problem dermatologiczny wiąże się z ryzykiem transformacji nowotworowej, co sprawia, że u pacjentów pojawia się wiele nurtujących pytań i wątpliwości. Poniżej odpowiedzi na najczęściej zadawane pytania.
Rogowacenie słoneczne najczęściej ma postać rumieniowych wykwitów, które są szorstkie w dotyku. Niekiedy pojawiają się również zmiany o typie strupów. Rogowacenie słoneczne cechuje się charakterystycznym obrazem dermatoskopowym, w którym obserwuje się między innymi tak zwany obraz truskawki.
Ustąpienie zmian związanych z rogowaceniem słonecznym można osiągnąć zarówno z wykorzystaniem leków stosowanych miejscowo, jak i metod zabiegowych (krioterapia, laseroterapia). Odpowiednią metodę leczenia rogowacenia słonecznego zaproponuje lekarz dermatolog.
Czas leczenia zależy przede wszystkim od wybranej metody terapeutycznej, jak i stosowania się do zaleceń. Leczenie rogowacenia słonecznego może trwać nawet kilka miesięcy.
Najważniejszym czynnikiem pogarszającym przebieg i będącym przyczyną pojawiania się zmian typowych dla rogowacenia słonecznego jest promieniowanie ultrafioletowe. Z tego powodu powinno się unikać narażenia na promieniowanie ultrafioletowe i stosować regularnie kremy z filtrem, najlepiej minimum SPF 50.
Rogowacenie słoneczne jest aktualnie zaliczane do tak zwanych raków in situ, co oznacza, że jest to przedinwazyjna postać nowotworu złośliwego skóry. Przy braku podjęcia leczenia istnieje ryzyko transformacji do inwazyjnej postaci raka skóry – mowa tutaj o raku kolczystokomórkowym.
Rogowacenie słoneczne – podsumowanie
- Rogowacenie słoneczne to przedinwazyjna postać raka kolczystokomórkowego skóry, która powstaje na skutek przewlekłej ekspozycji na promieniowanie ultrafioletowe.
- Rogowacenie słoneczne ma postać zmian rumieniowych o szorstkiej powierzchni, które lokalizują się przede wszystkim na skórze odsłoniętej, a więc na twarzy, szyi i grzbietach rąk.
- W diagnostyce rogowacenia słonecznego najważniejszą rolę odgrywa badanie przedmiotowe i badanie dermatoskopowe zmian skórnych.
- W terapii rogowacenia słonecznego stosuje się zarówno leki miejscowe, jak i postępowania zabiegowe. O sposobie leczenia powinien decydować lekarz dermatolog.
Bibliografia
- W. Placek, A. Markiewicz, N. Zając, M. Bzdawski, Rogowacenie słoneczne– definicja, etiopatogeneza i możliwości terapeutyczne, Przegl Dermatol 2013, 100, 171–177,
- B. Worley, V. Harikumar, K. Reynolds, Jak leczyć rogowacenie słoneczne? Arch. Dermatol. Res. 2022 Dec 1,
- A. Nasierowska-Guttmejer, M. Kołos, Patomorfologia – Słownik Onkologiczny, Wydawnictwo Lekarskie PZWL 2024,
- L. Rudnicka i inni, Współczesna Dermatologia, PZWL, Warszawa 2022.