Hipoglikemia reaktywna to spadek poziomu glukozy pojawiający się kilka godzin po posiłku. Dolegliwość ta może znacząco obniżać komfort życia, wywoływać lęk i utrudniać codzienne funkcjonowanie.
| Z tego artykułu dowiesz się: >> czym jest hipoglikemia reaktywna i czym różni się od innych typów niedocukrzenia, >> kto jest najbardziej narażony na hipoglikemię po posiłku, >> jakie są najczęstsze objawy hipoglikemii poposiłkowej i kiedy powinny skłonić do wizyty u lekarza, >> jakie mogą być przyczyny, w tym związek z insulinoopornością i ciążą, >> czy nieleczona hipoglikemia reaktywna jest niebezpieczna, >> jakie badania wykonuje się w diagnostyce — w tym krzywą cukrową i insulinową, >> jak wygląda leczenie i jakie nawyki pomagają zapobiegać spadkom glukozy, >> jak samodzielnie sprawdzić, czy możesz mieć hipoglikemię reaktywną i do jakiego lekarza się zgłosić. |
Spis treści:
- Hipoglikemia reaktywna: czym jest?
- Hipoglikemia reaktywna: objawy hipoglikemii poposiłkowej
- Hipoglikemia reaktywna: przyczyny niskiego poziomu cukru we krwi
- Czy hipoglikemia reaktywna jest niebezpieczna?
- Diagnostyka hipoglikemii reaktywnej: jakie badania wykonać?
- Jak leczyć hipoglikemię reaktywną?
- Czy można zapobiec hipoglikemii reaktywnej?
- Najczęstsze pytania o hipoglikemię po posiłku (FAQ)
Hipoglikemia reaktywna: czym jest?
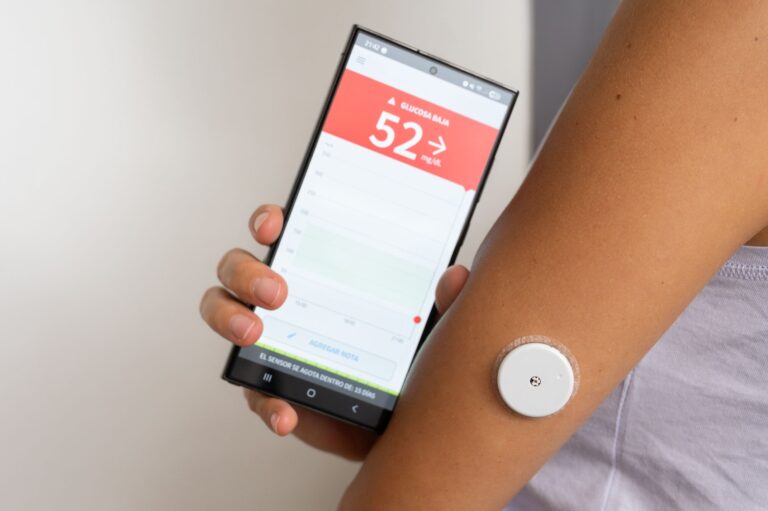
Hipoglikemia reaktywna (poposiłkowa) (ICD-10 E16.1) to stan, w którym poziom glukozy we krwi spada poniżej normy (tj. poniżej 70 mg/dl – 3,9 mmol/l), zazwyczaj 2-4 godziny po posiłku. Najczęściej dotyczy to osób bez cukrzycy. Do spadku dochodzi wskutek nadmiernej reakcji organizmu na spożyty posiłek — zwykle zbyt dużego wyrzutu insuliny.
>> Przeczytaj też: Hipoglikemia – objawy, przyczyny i leczenie niedocukrzenia
Kogo dotyczy hipoglikemia reaktywna?
Najczęściej hipoglikemię reaktywną obserwuje się u osób:
- z insulinoopornością,
- z predyspozycjami metabolicznymi,
- stosujących bardzo bogatą w węglowodany dietę,
- w okresie okołociążowym,
- po zabiegach bariatrycznych.
Nie jest to jednak reguła — niedocukrzenie poposiłkowe może pojawić się także u osób bez widocznych czynników ryzyka.
>> Zobacz: Insulinooporność a dieta. Zasady, jadłospis diety insulinowej

Hipoglikemia reaktywna: objawy hipoglikemii poposiłkowej
Objawy mogą być niespecyficzne, dlatego łatwo je pomylić z przemęczeniem czy stresem. Najczęściej pojawiają się nagle. Do typowych symptomów należą:
- drżenie rąk,
- kołatanie serca,
- silny głód,
- zawroty głowy,
- osłabienie, senność,
- uczucie niepokoju lub lęku,
- zimne poty,
- trudności z koncentracją.
Warto zwrócić uwagę na sytuacje, w których dolegliwości powtarzają się regularnie po jedzeniu — szczególnie po dużych, węglowodanowych posiłkach.
>> Przeczytaj również: Senność po jedzeniu – jakie są jej przyczyny i kiedy powinna niepokoić?
| To ważne: Warto zgłosić się do lekarza z podejrzeniem hipoglikemii poposiłkowej zawsze wtedy, gdy epizody niedocukrzenia powtarzają się regularnie lub utrudniają codzienne funkcjonowanie. Pilna konsultacja jest konieczna, jeśli epizod niedocukrzenia jest ciężki (utrata przytomności, trudności z mówieniem lub chodzeniem). |
Hipoglikemia reaktywna: przyczyny niskiego poziomu cukru we krwi
Najczęściej spadek glukozy wynika ze zbyt dużej ilości insuliny uwalnianej po posiłku. Może to być efekt:
- diety bogatej w cukry proste,
- insulinooporności — organizm próbuje „przebić” oporność tkanek zwiększoną produkcją insuliny,
- zaburzeń gospodarki hormonalnej,
- dysfunkcji trzustki,
- szybkiego opróżniania żołądka po operacjach bariatrycznych.
Czasem przyczyną są nieregularne posiłki lub długie przerwy w jedzeniu.
Hipoglikemia reaktywna w ciąży
W ciąży częściej dochodzi do wahań poziomu glukozy, dlatego objawy hipoglikemii poposiłkowej mogą się nasilać. Zwykle wynika to ze zmian hormonalnych i większego zapotrzebowania energetycznego. Jeśli jesteś w ciąży i obserwujesz częste epizody niedocukrzenia, warto omówić to z diabetologiem — pozwoli to wykluczyć zaburzenia gospodarki węglowodanowej.
>> Zobacz: Cukrzyca ciążowa
Czy hipoglikemia reaktywna jest niebezpieczna?
Sporadyczne epizody zwykle nie stanowią zagrożenia. Problem pojawia się, gdy niedocukrzenie powtarza się często. Objawy mogą prowadzić do:
- omdleń,
- trudności z prowadzeniem pojazdów,
- napadów lęku,
- przewlekłego zmęczenia i zaburzeń koncentracji.
Nieleczona hipoglikemia reaktywna może także sprzyjać przejadaniu się, a w konsekwencji — zwiększać ryzyko tycia.
| Warto wiedzieć: Hipoglikemia reaktywna i insulinooporność często są ze sobą powiązane. Przy insulinooporności trzustka wydziela więcej insuliny, aby obniżyć poziom glukozy. U części osób ten wyrzut jest zbyt duży, co po kilku godzinach prowadzi do spadku cukru – czyli hipoglikemii poposiłkowej. Nie każda osoba z insulinoopornością jej doświadcza, ale ryzyko jest większe. Dlatego przy podejrzeniu obu zaburzeń warto wykonać krzywą cukrową i insulinową. |
Diagnostyka hipoglikemii reaktywnej: jakie badania wykonać?
Diagnostyka obejmuje przede wszystkim ocenę objawów i badań laboratoryjnych. Za hipoglikemie uznaje się stężenie glukozy poniżej 70 mg/dl. Lekarz może zalecić:
- glukozę i insulinę na czczo,
- krzywą cukrową,
- krzywą insulinową,
- badania ogólne — m.in. morfologię, elektrolity, TSH i hormony tarczycy, ew. IGF-1 i poranne oznaczenie kortyzolu.
Czasem konieczna jest diagnostyka różnicowa w kierunku chorób trzustki lub zaburzeń hormonalnych.

Krzywa cukrowa w hipoglikemii reaktywnej
W przebiegu testu doustnego obciążenia glukozą (OGTT) — tzw. krzywej cukrowej — u części osób poziom glukozy początkowo rośnie, a następnie spada poniżej wartości prawidłowych. Wynik taki może sugerować hipoglikemię reaktywną, szczególnie jeśli towarzyszą mu objawy w trakcie testu.
Jak leczyć hipoglikemię reaktywną?
Leczenie polega głównie na modyfikacji stylu życia. Najczęściej zaleca się:
- Regularne, mniejsze posiłki co 3-4 godziny,
- Ograniczenie cukrów prostych,
- Produkty o niskim indeksie glikemicznym,
- Dodatek białka i zdrowych tłuszczów do posiłków,
- Unikanie słodkich napojów i dużych posiłków wieczornych.
W niektórych przypadkach konieczna jest opieka diabetologa oraz włączenie leków poprawiających wrażliwość tkanek na insulinę.
>> Sprawdź: Jak działa metformina? Skutki uboczne, monitorowanie stanu zdrowia podczas terapii
Czy można zapobiec hipoglikemii reaktywnej?
Tak — podstawą jest stabilizacja poziomu glukozy we krwi. Warto zadbać o regularną aktywność fizyczną, prawidłowy sen, unikanie dużych dawek kofeiny na pusty żołądek oraz odpowiednie nawodnienie.
Najczęstsze pytania o hipoglikemię po posiłku (FAQ)
Jak sprawdzić, czy ma się hipoglikemię reaktywną?
Najlepiej wykonać badania krwi, szczególnie krzywą cukrową i insulinową. Pomocne bywa także mierzenie glukozy glukometrem w trakcie objawów.
Jak wyjść z hipoglikemii reaktywnej?
W momencie wystąpienia objawów warto przyjąć szybko przyswajalny węglowodan, np. sok. W dłuższej perspektywie kluczowa jest zmiana diety.
Jaki lekarz leczy hipoglikemię reaktywną?
Najczęściej diabetolog lub endokrynolog, ale w pierwszej kolejności możesz zgłosić się do lekarza rodzinnego.
Bibliografia
- Altuntaş Y. Postprandial Reactive Hypoglycemia. Sisli Etfal Hastan Tip Bul. 2019
- Gϋemes M, et al. Hyperinsulinemic hypoglycemia in children and adolescents: Recent advances in understanding of pathophysiology and management. Rev Endocr Metab Disord. 2020
- Cruz P. Inpatient Hypoglycemia: The Challenge Remains. J Diabetes Sci Technol. 2020