Niektóre zmiany skórne, zaliczane do zmian łagodnych, będących tylko defektem natury estetycznej, w przypadku licznego i nagłego pojawienia się powinny wzbudzić naszą czujność onkologiczną. Tego rodzaju zmianami są właśnie brodawki łojotokowe. Jak wygląda brodawka łojotokowa i o czym może świadczyć nagły wysiew tego rodzaju zmian? Co to jest objaw Lesera-Trelata? Przeczytaj poniższy artykuł i dowiedz się więcej na ten ważny temat.
Spis treści:
- Co to jest rogowacenie łojotokowe?
- Jak wygląda rogowacenie łojotokowe (brodawka łojotokowa)?
- Kiedy mówimy o zespole Lesera-Trelata? Jakie są objawy?
- Brodawka łojotokowa a rak skóry i czerniak
- Rogowacenie łojotokowe – przyczyny
- Rogowacenie łojotokowe – rozpoznanie i leczenie zespołu Lesera-Trelata
- Rogowacenie łojotokowe: podsumowanie informacji
Co to jest rogowacenie łojotokowe?
Rogowacenie łojotokowe, nazywane częściej brodawką łojotokową (w klasyfikacji ICD 10 oznaczaną jako L82) to łagodna zmiana skórna, będąca częstym znaleziskiem w czasie badania dermatoskopowego. Brodawki łojotokowe nazywane są również brodawkami starczymi, co związane jest z faktem ich liczniejszego pojawiania się właśnie w podeszłym wieku. Zmiany te zaliczane są do łagodnych nowotworów naskórkowych, co oznacza, że wywodzą się z komórek naskórka, czyli najbardziej zewnętrznie położonej warstwy skóry.
>> Dowiedz się więcej: Choroby skóry u człowieka. Najczęściej występujące dermatozy
Jak wygląda rogowacenie łojotokowe (brodawka łojotokowa)?
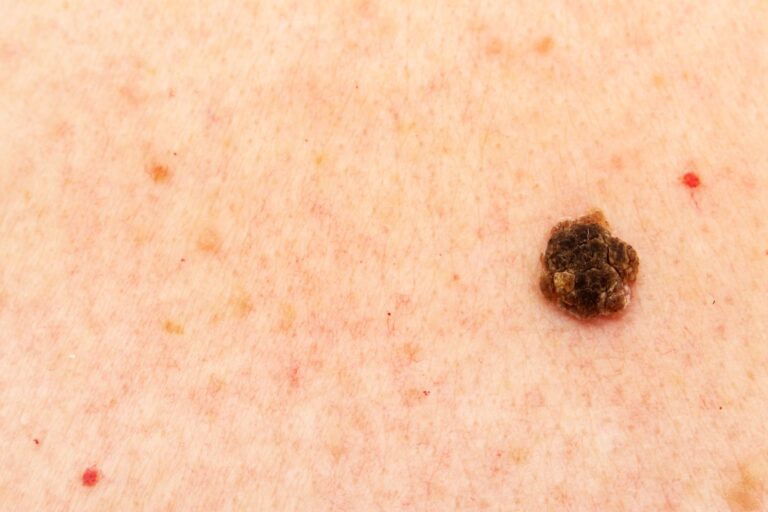
Brodawka łojotokowa to zmiana wyniosła ponad poziom skóry, wyczuwalna palpacyjnie, typowo o owalnym kształcie. Brodawki łojotokowe początkowo są stosunkowo gładkie i przyjmują beżową barwę. Z czasem jednak ich powierzchnia staje się bardziej hiperkeratotyczna (pobruzdowana, szorstka). Pacjenci mogą również podawać, że zmiana z czasem się powiększa i ciemnieje. “Starsze” brodawki łojotokowe są bowiem bardziej chropowate i przyjmują brązową, a nawet czarną barwę, co często wzbudza niepokój wśród pacjentów i skłania do wizyty u specjalisty. Warto też dodać, że wykwity te mają tendencję do występowania w większych skupiskach.
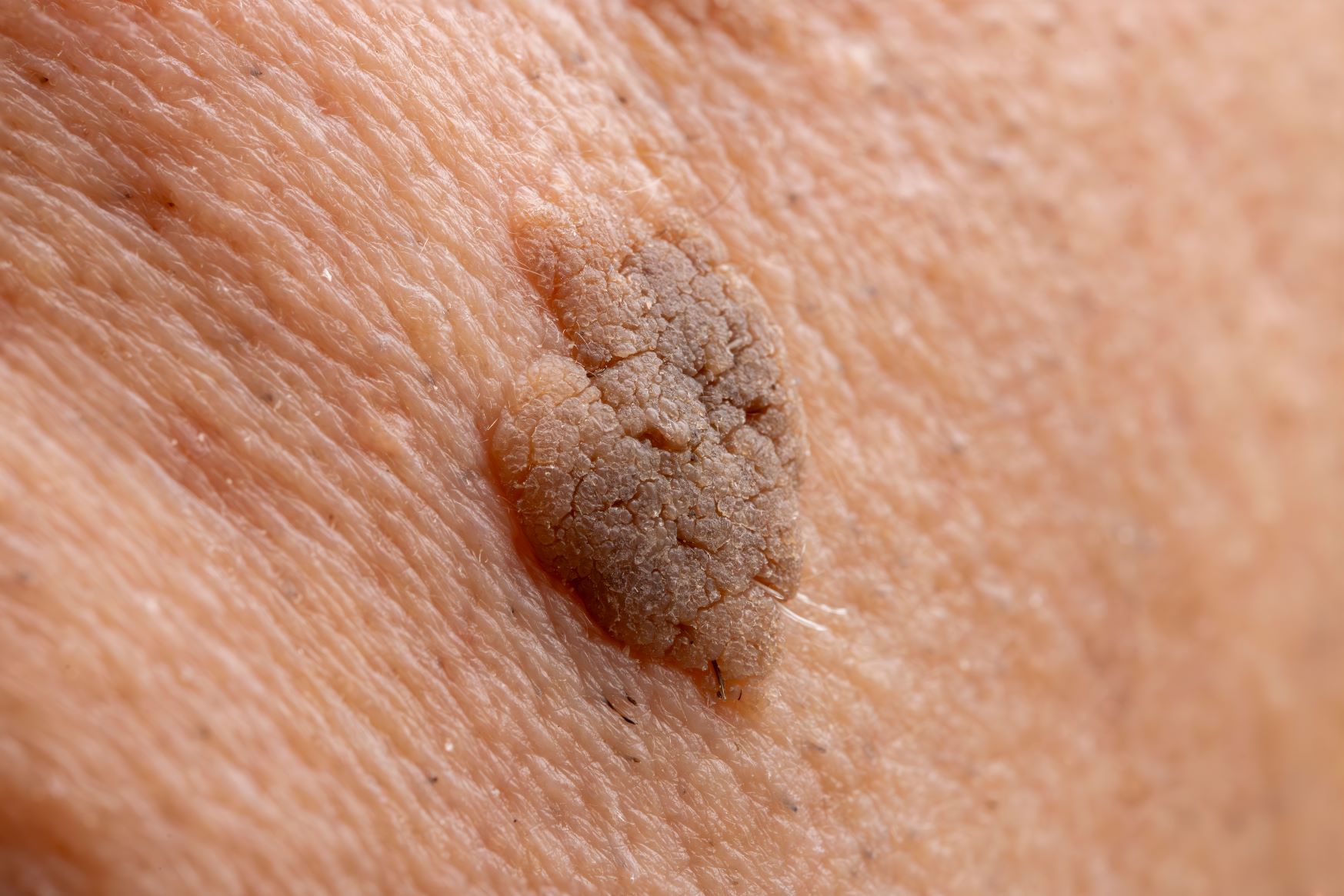
Kiedy mówimy o zespole Lesera-Trelata? Jakie są objawy?
Zespół Lesera-Trelata to nagłe pojawienie się na skórze pacjenta licznych brodawek łojotokowych. Zmianom skórnym w tym zespole bardzo często towarzyszy uporczywy świąd i związany z tym dyskomfort. Nagłe pojawienie się wielu brodawek łojotokowych może być skórnym objawem rozwijającego się nowotworu, najczęściej umiejscowionego w obrębie przewodu pokarmowego. Zespół Lesera-Trelata występuje z tą samą częstością u obu płci.
Nowotwory związane z omawianym w tym artykule zespołem to przede wszystkim:
- gruczolakorak żołądka,
- gruczolakorak jelita grubego,
- raki płaskonabłonkowe,
- białaczki i chłoniaki.
Należy mieć jednak świadomość, że zespół Lesera-Trelata musi być zjawiskiem nagłym. Liczne brodawki łojotokowe na skórze pacjenta, które pojawiają stopniowo nie są tożsamym zjawiskiem i nie wiążą się z ryzykiem onkologicznym.
Dlaczego niektóre nowotwory wiążą się z wysiewem brodawek łojotokowych? Niektóre gruczolakoraki przewodu pokarmowego wytwarzają specjalne czynniki wzrostu (w tym IGF-1, TGF-α, czy też EGF), które stymulują komórki skóry i tym samym powstawanie brodawek łojotokowych. Czynniki te prowadzą do nagłego wysiewu zmian.
>> Przeczytaj także: Chłoniak skóry – objawy, przyczyny, diagnostyka i leczenie
Brodawka łojotokowa a rak skóry i czerniak
Jak już wspomniano, brodawki łojotokowe to zmiany łagodne, niewzbudzające niepokoju onkologicznego (o ile nie pojawiają się nagle w dużych ilościach). Z kolei czerniak i raki skóry, takie jak rak podstawnokomórkowy, czy rak kolczystokomórkowy są zmianami złośliwymi, które wiążą się z ryzykiem miejscowej ekspansji, a nawet przerzutów i zgonu pacjenta. Dlatego bardzo ważne jest odróżnienie brodawki łojotokowej od wykwitów, będących zmianami złośliwymi. W tym celu konieczna jest konsultacja dermatologiczna, wraz z badaniem dermatoskopowym.
>> Warto wiedzieć: Czerniak a pieprzyk – czym się różnią i jak je rozpoznać?
Rogowacenie łojotokowe – przyczyny
Brodawki łojotokowe powstają na skutek nadmiernego namnażania się komórek (keratynocytów) warstwy podstawnej naskórka. Warstwa podstawna to najgłębiej położona warstwa naskórka, która spoczywa na specjalnej strukturze, nazywanej błoną podstawną. Przyczyny pojawiania się brodawek łojotokowych (niezwiązanych z zespołem Lesera-Trelata) nie są dokładnie poznane. Uważa się jednak, że dużą rolę odgrywają tutaj czynniki genetyczne, zauważalna jest bowiem genetyczna predyspozycja do pojawiania się na skórze tego rodzaju zmian.
Co więcej, istnieje również związek ze zwiększonym narażeniem na promieniowanieu ultrafioletowe, a pojawianiem się brodawek łojotokowych. Ponadto, badania donoszą, że pacjenci leczeni onkologicznie, z wykorzystaniem inhibitorów receptora czynnika wzrostu naskórka są bardziej narażeni na pojawienia się tego rodzaju zmian skórnych.
Rogowacenie łojotokowe – rozpoznanie i leczenie zespołu Lesera-Trelata
Na wstępie tego akapitu należy wyjaśnić, jak dermatolog rozpoznaje zwykłą brodawkę łojotokową. W wielu przypadkach rozpoznanie to można postawić już na podstawie oglądania zmiany gołym okiem. Jednak podstawą jest badanie dermatoskopowe, a więc oglądanie zmiany w powiększeniu przy użyciu narzędzia nazywanego dermatoskopem. Obraz dermatoskopowy pozwala w większości przypadków na potwierdzenie lub wykluczenie rozpoznania brodawki łojotokowej. Badanie to pozwala na uwidocznienie charakterystycznych, dermatoskopowych cech brodawek łojotokowych, w tym między innymi:
- ostro odgraniczona krawędź zmiany,
- obecność zakrzywionych linii, przypominających mózgoidalny kształt,
- licznych pomarańczowych lub żółtawych grudek.
Warto podkreślić, że w dermatologii funkcjonuje jeszcze zespół określany mianem pseudo-zespołu Lesera-Trelata. Schorzenie to pojawia się na skutek leczenia przeciwnowotworowego, którego skutkiem jest stan zapalny wokół istniejących już na skórze brodawek łojotokowych.
W odniesieniu do podejrzenia zespołu Lesera-Trelata konieczne jest przeprowadzenie pilnej diagnostyki onkologicznej. W tym celu niezbędne jest wykonanie między innymi takich badań laboratoryjnych i procedur medycznych jak:
- morfologia krwi obwodowej + rozmaz,
- markery nowotworowe, w tym m. in. CEA, CA 19-9,
- badanie kału w kierunku krwi utajonej,
- badania endoskopowe, w tym kolonoskopia i gastroskopia,
- RTG klatki piersiowej,
- tomografia komputerowa jamy brzusznej i miednicy mniejszej i/lub klatki piersiowej,
- USG jamy brzusznej,
- w razie podejrzenia choroby hematologicznej – biopsja szpiku kostnego.
Badania laboratoryjne i obrazowe są zlecane przez lekarza prowadzącego w oparciu o przeprowadzony wywiad choroby i badanie przedmiotowe chorego.
Leczenie zespołu Lesera-Trelata wymaga terapii choroby podstawowej, a więc leczenia onkologicznego zdiagnozowanego nowotworu. Warto jednak przedstawić w tym miejscu również możliwe postępowanie w odniesieniu do brodawek łojotokowych, niezwiązanych z zespołem Lesera-Trelata. W celu usunięcia tego rodzaju zmian można zastosować takie procedury jak na przykład:
- elektrokoagulacja,
- krioterapia,
- laseroterapia,
- wycięcie chirurgiczne zmiany.
Usunięcie chirurgiczne wraz z badaniem histopatologicznym wykonuje się najczęściej wówczas, gdy nie ma pewności klinicznej, co do rozpoznania brodawki łojotokowej. Badanie histopatologiczne pozwala bowiem na potwierdzenie rozpoznania i wykluczenie innych zmian skórnych, również tych złośliwych (na przykład raka podstawnokomórkowego, czy czerniaka).
Rogowacenie łojotokowe: podsumowanie informacji
- Brodawka łojotokowa to łagodny wykwit skórny, często obecny na skórze pacjentów, szczególnie w podeszłym wieku.
- Liczny wysiew brodawek łojotokowych może być związany z rozwijającym się nowotworem złośliwym i nazywany jest w dermatologii zespołem Lesera-Trelata.
- Zespół Lesera-Trelata najczęściej związany jest z nowotworami rozwijającymi się w obrębie przewodu pokarmowego.
- Przy podejrzeniu zespołu Lesera-Trelata konieczna jest wnikliwa diagnostyka onkologiczna, zarówno laboratoryjna, jak i endoskopowa.
- Leczenie zespołu Lesera-Trelata wymaga terapii onkologicznej choroby podstawowej.
Bibliografia
- B. Młynarczyk-Bonikowska, J. Muszyński i inni, Objawy dermatologiczne towarzyszące nowotworom układu pokarmowego, Przegl Dermatol 2017, 104, 31–39,
- T. Yamamoto, Leser-Trelat sign: current observations. Exp Rev Dermatol 2013, 8, 541-546,
- A. Nasierowska-Guttmejer, M. Kołos, Patomorfologia – Słownik Onkologiczny, Wydawnictwo Lekarskie PZWL 2024,
- L. Rudnicka i inni, Współczesna Dermatologia, PZWL, Warszawa 2022.