Infekcje przewodu pokarmowego od wielu lat stanowią duży problem zdrowotny bez względu na to, czy dotyczą dziecka, czy osoby dorosłej. Często, zanim rozwinie się w pełni choroba, mamy styczność z czynnikiem zakaźnym już kilka lub kilkanaście dni wcześniej. W jaki sposób rozpoznać objawy u dziecka mogące być początkiem tzw. grypy żołądkowej? Czy istnieją metody, które chronią przed rozwojem ostrych nieżytów żołądkowo-jelitowych u najmłodszych? Czy każdą infekcję należy leczyć w szpitalu?
| Kluczowe informacje: >> Infekcyjne nieżyty żołądkowo-jelitowe, potocznie nazywane grypą żołądkową, to jedne z częstszych przyczyn konsultacji w gabinetach lekarzy opiekujących się dziećmi i młodzieżą. >> Zakażenia przewodu pokarmowego zwłaszcza u dzieci poniżej 5 roku życia stanowią częste przyczyny hospitalizacji. >> Leczenie ostrych nieżytów żołądkowo-jelitowych uwzględnia czynniki wywołujące chorobę i obejmuje zarówno nawodnienie, lekkostrawną dietę, a niejednokrotnie także antybiotyki lub leki przeciwpasożytnicze. |
Spis treści:
- Przyczyny jelitówki u dzieci i niemowląt
- Grypa żołądkowa u dzieci: objawy dolegliwości
- Jelitówka u dziecka: kiedy do szpitala?
- Diagnostyka grypy żołądkowej u dzieci: jakie badania wykonać?
- Co na jelitówkę u dzieci i niemowląt?
- Czy można zapobiec jelitówce u dziecka lub niemowlaka?
- Grypa jelitowa u dzieci: najczęstsze pytania (FAQ)
- Jelitówka u niemowląt i dzieci: podsumowanie informacji
Przyczyny jelitówki u dzieci i niemowląt
Zarówno w populacji niemowlęcej, jak i dziecięcej, przeważają przyczyny wirusowe dolegliwości ze strony przewodu pokarmowego prowadzące do tzw. grypy żołądkowej. Wśród czynników tych znajdują się m.in.: rotawirusy, adenowirusy, norowirusy, wirus zapalenia wątroby typu A (WZW A), wirus grypy, wirus SARS-CoV-2. Spośród przyczyn bakteryjnych zwracają uwagę przede wszystkim szczepy: Salmonella, Shigella, Esherichia coli, Campylobacter, Helicobacter pylori, Yersinia; wśród przyczyn pasożytniczych w głównej mierze są to glista ludzka i Lamblia intestinalis.
>> Więcej informacji o przyczynach biegunki zakaźnej można dowiedzieć się m.in. z artykułu: Biegunka u dzieci i niemowląt. Możliwe przyczyny, postępowanie, badania
Grypa żołądkowa u dzieci: objawy dolegliwości
W zależności od wieku dziecka dotkniętego nieżytem żołądkowo-jelitowym o podłożu infekcyjnym, możemy obserwować różne spektrum objawów i dolegliwości.
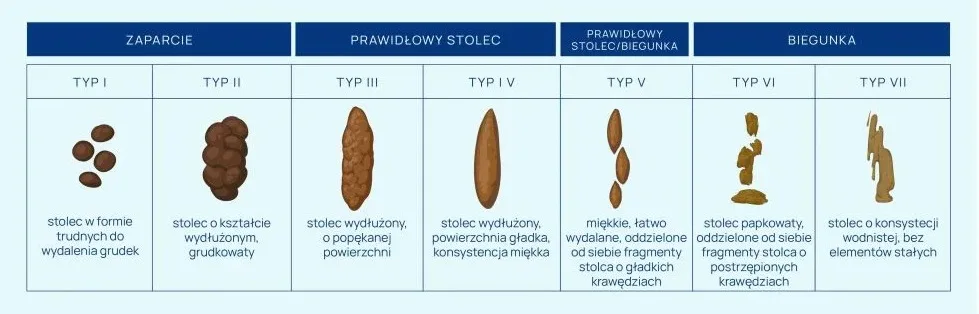
W przypadku niemowląt są to najczęściej: rozdrażnienie, zmniejszenie apetytu, nasilenie ulewań, wymioty treścią pokarmową, luźne i częstsze niż zazwyczaj stolce prowadzące do biegunki. Czasami pierwsze objawy są dość dyskretne (można zaobserwować apatię, gorsze samopoczucie, rozdrażnienie, nadmierną płaczliwość dziecka). Pojawia się podwyższona temperatura ciała, która nie zawsze musi być tożsama z wystąpieniem gorączki. Z innych dolegliwości zwracają uwagę nudności, osłabienie apetytu, wzdęcia i nadmiernie odchodzące gazy.
Starsze dzieci mogą zgłaszać bóle lub zawroty głowy, bóle mięśni i stawów czy też objawy wskazujące na zajęcie przez infekcję dróg oddechowych, takie jak: blokada nosa, wyciek wydzieliny z nosa, bóle gardła, kaszel, zapalenie spojówek.
Jelitówka u dziecka: kiedy do szpitala?
Wskazaniami do hospitalizacji niemowląt i dzieci w przebiegu nieżytu żoładkowo-jelitowego są takie sytuacje kliniczne jak:
- wiek poniżej 3 miesiąca życia;
- intensywne wymioty i brak poprawy po próbach nawadniania doustnego;
- wykluczenie chirurgicznego podłoża występujących objawów;
- zły stan ogólny dziecka: nadmierne osłabienie, rozdrażnienie, senność, apatia;
- trudności w diagnostyce ambulatoryjnej;
- ciężkie odwodnienie z ubytkiem masy ciała powyżej 10%.
>> Sprawdź: Przewlekły ból brzucha u dzieci. Kiedy powinien nas niepokoić?
Diagnostyka grypy żołądkowej u dzieci: jakie badania wykonać?
Podstawą diagnostyki zaburzeń żołądkowo-jelitowych, o etiologii infekcyjnej, jest dobrze zebrany od opiekunów wywiad odnośnie występujących u dziecka objawów i dolegliwości. Uzupełnieniem jest badanie fizykalne dziecka z oceną nawodnienia powłok skórnych i badaniem jamy brzusznej.
W sytuacjach trudnych diagnostycznie pomocna jest ocena saturacji, ciśnienia tętniczego krwi, temperatury ciała. Laboratoryjnie możemy ocenić:
- morfologię z rozmazem,
- stężenie białka C-reaktywnego (CRP),
- stężenie elektrolitów: sodu, potasu,
- stężenie glukozy,
- badanie ogólne moczu,
- badanie kału w kierunku nosicielstwa pałeczek Salmonella, Shigella,
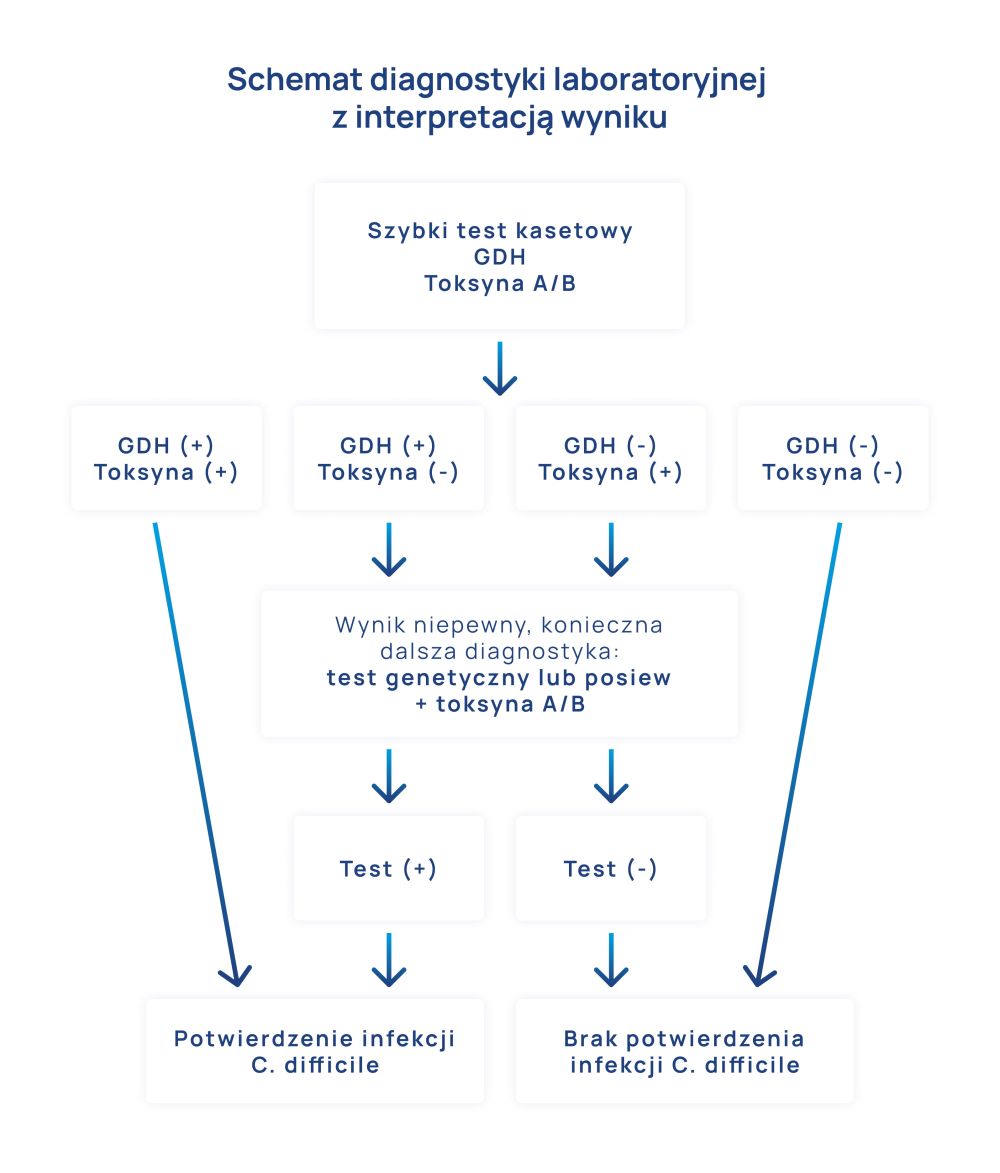
- badanie kału poprzez szybkie testy diagnostyczne wykrywające najczęstsze wirusy wywołujące biegunki infekcyjne,
- posiew kału celowany na konkretną florę bakteryjną,
- badanie kału w kierunku pasożytów.

Co na jelitówkę u dzieci i niemowląt?
Podstawą leczenia ostrego nieżytu żołądkowo-jelitowego jest podawanie doustnych płynów nawadniających, czyli preparatów elektrolitowych. Na rynku dostępnych jest wiele preparatów o różnym smaku i gramaturze. Są także gotowe rozpuszczone płyny, które jedynie wystarczy podać dziecku do nawadniania.
Zasady nawadniania doustnego obejmują odpowiednie proporcje podawanego płynu w przeliczeniu na masę ciała dziecka w kolejnych etapach leczenia. W fazie wstępnej jest to:
- od 50 do 100 ml/kg masy ciała w ciągu pierwszych 4-6 godzin, z tym że podawanie płynów powinno odbywać się powoli i małymi porcjami, a po każdym luźniejszym stolcu jest to od 5 do 10 ml na każdy kg masy ciała dziecka.
W fazie podtrzymującej leczenie ilość niezbędnych do nawodnienia płynów wylicza się wg. kryteriów:
- u dzieci ważących poniżej 10 kg jest to 100ml/kg m. c.
- u dzieci o wadze 10-20 kg jest to 1000ml +50ml/każdy dodatkowy kg masy ciała powyżej 10 kg.
- u dzieci o wadze powyżej 20kg jest to 1500 ml+ 20 ml na każdy kg masy ciała powyżej 20 kg
W sytuacji przedłużającej się biegunki zalecane są takie preparaty jak: racekadotryl, smektyn, probiotyki. Racekadotryl jest prepararem dostępnym na receptę. Pozostałe preparaty są dostępne w aptekach.
W rzadkich przypadkach, gdy nieżyt żołądkowo-jelitowy ma podłoże bakteryjne, stosowane są antybiotyki: doustnie lub w przypadku pogorszenia samopoczucia dziecka i braku możliwości podawania leków doustnie, drogą dożylną w warunkach szpitalnych.
>> Przeczytaj: Co podawać dziecku do jedzenia, gdy jest chore?
Jelitówka u dzieci: domowe sposoby na grypę żołądkową
W przypadku niemowląt karmionych piersią wskazane jest kontynuowanie karmienia naturalnego na żądanie.
Niemowlęta karmione mieszankami mlecznymi powinny mieć uzupełniane płyny drogą doustną, a w późniejszym etapie leczenia stopniowo wprowadzane dotychczasowe produkty dietetyczne.
U dzieci starszych sprawdzają się herbatki ziołowe np. z rumianku, lekkostrawna dieta z ograniczeniem produktów mlecznych, surowych owoców i warzyw, a także uzupełnianie płynów poprzez podawanie soku jabłkowego rozcieńczonego z wodą czy kisieli domowej roboty.

Czy można zapobiec jelitówce u dziecka lub niemowlaka?
Nie każdej infekcji przewodu pokarmowego u małych dzieci można uniknąć. Podstawą ochrony przed wystąpieniem nieżytu żołądkowo-jelitowego jest higiena rąk, unikanie spożywania posiłków w miejscach o niepewnym statusie sanitarnym, a także profilaktyka w postaci szczepień ochronnych. Od 2020 roku w polskim kalendarzu szczepień ochronnych znajduje się szczepienie niemowląt przeciwko rotawirusom. Szczepienie to obowiązuje między 7. a 24. tygodniem życia dziecka i chroni przed jednymi z częstszych patogenów wirusowych, które wywołują ostre nieżyty żołądkowo-jelitowe. Rotawirusy są jednymi z częstszych przyczyn hospitalizacji wśród dzieci do 5. roku życia.
Ponadto zalecane są szczepienia przeciwko grypie sezonowej (co sezon infekcyjny).
Grypa jelitowa u dzieci: najczęstsze pytania (FAQ)
Jak rozpoznać objawy infekcji żołądkowo- jelitowej u dziecka? W ciągu ilu dni dziecko może czuć się gorzej w związku z tzw. jelitówką?
Trudno jednoznacznie określić, jakie dolegliwości pojawiają się w trakcie nieżytu żołądkowo-jeltowego u dzieci jako pierwsze. Czasami pierwsze objawy są dość dyskretne jak apatia, gorsze samopoczucie, rozdrażnienie, nadmierna płaczliwość dziecka. Pojawia się podwyższona temperatura ciała, która nie zawsze musi być tożsama z wystąpieniem gorączki.
Z innych dolegliwości zwracają uwagę nudności, osłabienie apetytu, wzdęcia i nadmiernie odchodzące gazy, luźniejsze stolce. Starsze dzieci mogą zgłaszać zawroty lub bóle głowy, bóle mięśni i stawów czy też objawy wskazujące na zajęcie przez infekcję dróg oddechowych: blokada nosa, wyciek wydzieliny z nosa, bóle gardła, kaszel, zapalenie spojówek.
W zależności od czynnika etiologicznego i zdolności obronnych organizmu dziecka, choroba może trwać od 3 do 14 dni. Do pierwszego kontaktu z patogenem dochodzi często już kilka dni przed wystąpieniem pierwszych objawów.
Korzystanie ze spacerów na świeżym powietrzu nie jest przeciwwskazane w przypadku większości chorób przebiegających u dzieci. O ile stan zdrowia dziecka pozwala na przebywanie na świeżym powietrzu, należy z tego korzystać. Warunkiem jest brak gorączki, osłabienia i innych dolegliwości, które mogą wpłynąć na złe samopoczucie u dziecka i ograniczyć jego chęci do wyjścia na chociaż krótki spacer.
Jelitówka u niemowląt i dzieci: podsumowanie informacji
- Niemal każde dziecko w ciągu pierwszych lat swojego życia zachorowało chociaż raz na ostry nieżyt żołądkowo-jelitowy.
- Wśród głównych przyczyn zakażeń przewodu pokarmowego w populacji dziecięcej zaliczamy: wirusy, bakterie, pasożyty.
- Głowne objawy towarzyszące infekcji to: bóle brzucha, biegunka, wymioty, czasami także gorączka lub stany podgorączkowe.
- Nie każda jelitówka u dziecka jest wskazaniem do leczenia w warunkach szpitalnych.
- Podstawą leczenia bez względu na przyczynę wywołującą zakażenie jest zapobieganie odwodnieniu i zaburzeniom elektrolitowym w przebiegu choroby.
Bibliografia
- A. Dobrzańska, Ł. Obrycki, P. Socha; „Pediatria w praktyce lekarza POZ”, wyd. Standardy medyczne, Warszawa 2022.
- W. Kawalec, R. Grenda, H. Ziółkowska „Pediatria”, wyd. PZWL.