Pokrzywka to powszechny problem medyczny, którym zajmują się zarówno lekarze alergolodzy, jak i dermatolodzy. Co to jest pokrzywka alergiczna? Jak objawia się pokrzywka alergiczna i na czym polega diagnostyka tego schorzenia? Przeczytaj poniższy artykuł i dowiedz się jakie badania warto wykonać w celu identyfikacji przyczyn pokrzywki alergicznej.
Spis treści:
- Jak wygląda pokrzywka alergiczna?
- Pokrzywka alergiczna – ile trwa?
- Przyczyny pokrzywki alergicznej. Od czego powstają bąble i plamy?
- Pokrzywka alergiczna – jak leczyć?
- Czy pokrzywka alergiczna jest groźna dla zdrowia?
- Jak przeciwdziałać powstawaniu pokrzywki alergicznej?
Jak wygląda pokrzywka alergiczna?
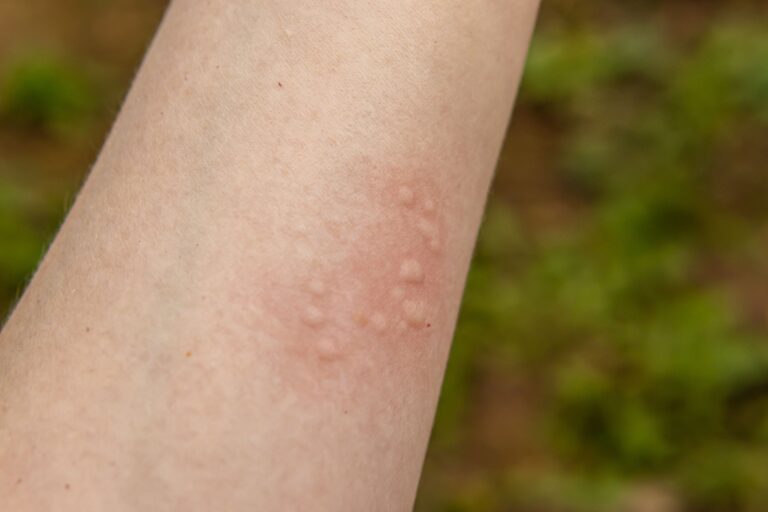
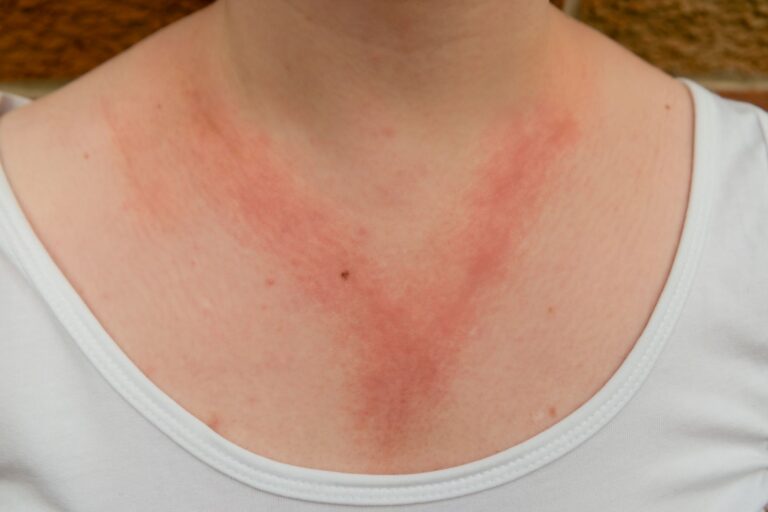
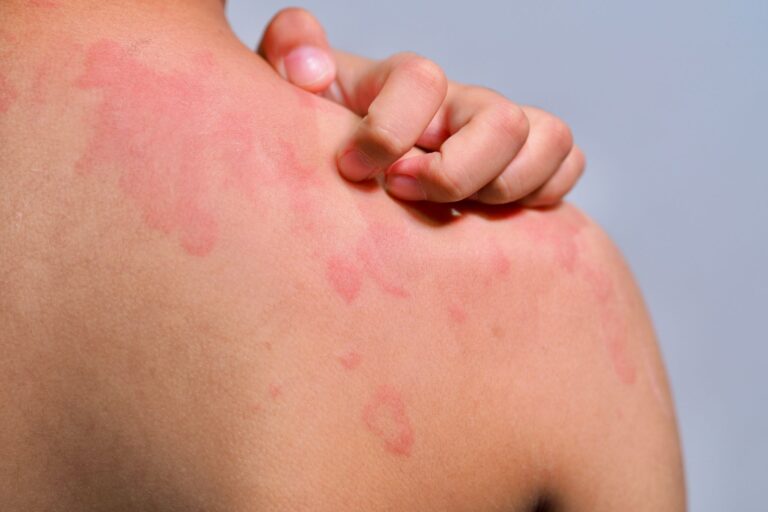
Typową manifestacją kliniczną pokrzywki alergicznej jest wysiew zmian skórnych w postaci bąbli pokrzywkowych. Bąbel pokrzywkowy to zmiana wyniosła ponad poziom skóry, która klasycznie przyjmuje lekko różową lub porcelanowo-białą barwę.
Bąble pokrzywkowe mogą się ze sobą zlewać i tworzyć na skórze pacjenta różnorodne struktury o nieregularnych kształtach.
>> Sprawdź: Pokrzywka u dziecka – jak ją rozpoznać i leczyć?
Charakterystyczne dla pokrzywki jest to, że bąble pokrzywkowe nie utrzymują się na skórze zbyt długo. Typowo znikają do 24 godzin, jednak zazwyczaj przebieg choroby jest dość zmienny, co oznacza, że jedne bąble znikają, a drugie pojawiają się. Zmianom skórnym towarzyszy świąd, a niekiedy również pieczenie skóry.
W niektórych przypadkach zmianom skórnym mogą towarzyszyć objawy obrzęku naczynioruchowego. Manifestuje się on pojawieniem się zmian obrzękowych w dolnych warstwach skóry i w tkance podskórnej. Obrzęk naczynioruchowy często dotyczy takich lokalizacji jak powieki, czerwień wargowa, a także narządy płciowe i drogi oddechowe.
>> Przeczytaj też: Pokrzywka: objawy, przyczyny, rodzaje
Pokrzywka alergiczna – ile trwa?
Pokrzywka alergiczna może mieć różny czas trwania. Schorzenie to można podzielić na:
- pokrzywkę alergiczną ostrą – kiedy objawy utrzymują się do 6 tygodni,
- pokrzywkę alergiczną przewlekłą – kiedy symptomy trwają powyżej 6 tygodni.
Warto wspomnieć, że nawet u co czwartego pacjenta w czasie trwania życia będzie obserwować się epizod pokrzywki ostrej. Pokrzywka przewlekła jest zdecydowanie rzadszym zjawiskiem, bowiem dotyczy około 1% populacji. Jak pokazują dane statystyczne u połowy chorych objawy pokrzywki przewlekłej utrzymują się nie dłużej, niż dwa lata, a u około 20% trwają znacznie dłużej, ponad 10 lat.
>> Przeczytaj: Egzema skóry – co to jest, objawy i leczenie egzemy na dłoniach i twarzy
Przyczyny pokrzywki alergicznej. Od czego powstają bąble i plamy?
Przyczyną pojawienia się bąbli pokrzywkowych jest uwolnienie histaminy, która prowadzi do zwiększenia przepuszczalności w obrębie naczyń włosowatych, co prowadzi do pojawienia się obrzęku i charakterystycznych wykwitów chorobowych. W przebiegu pokrzywki alergicznej reakcja ta wzbudzana jest przez różnego rodzaju alergeny, do których należą między innymi:
- alergeny pokarmowe – najczęściej jaja, orzechy, mleko, soja, ale także ryby i skorupiaki,
- alergeny powietrznopochodne (wziewne) – w tym pyłki traw, roztocze kurzu domowego; alergeny wziewne są stosunkowo rzadką przyczyną zmian o typie pokrzywki; alergeny wziewne mogą wchodzić w reakcje krzyżowe z alergenami pokarmowymi,
- alergeny w postaci leków – antybiotyki, substancje stosowane do znieczulenia, leki przeciwzapalne,
- alergeny kontaktowe – w tym między innymi lateks, żywice, siarczan amonu czy też formaldehyd; alergeny te mogą odpowiadać za rodzaj pokrzywki, który określany jest mianem pokrzywki kontaktowej.
To może Cię zainteresować:
>> Alergeny, czyli co najczęściej uczula. Rodzaje i lista alergenów
>> Znajdź swój alergen – diagnostyka alergii w laboratorium
Pokrzywka alergiczna – jak leczyć?
W leczeniu farmakologicznym pokrzywki zastosowanie znajdują leki przeciwhistaminowe, potocznie nazywane lekami przeciwalergicznymi. Lekami z wyboru są substancje antyhistaminowe II generacji, w tym bilastyna, loratadyna czy desloratadyna. Ich zastosowanie wiąże się z mniejszym natężeniem działań niepożądanych typowych dla leków antyhistaminowych (mowa tutaj przede wszystkim o działaniu sedacyjnym). Można je zastosować w zwiększonej dawce, równej czterokrotności dawki podstawowej.
Jeżeli leczenie pierwszego rzutu nie przynosi rezultatów, konieczne może być włączenie leczenia immunosupresyjnego w postaci cyklosporyny i w kolejnym kroku, z wykorzystaniem leczenia biologicznego (omalizumab).
Jakie badania wykonać przy rumieniu alergicznym?
W przypadku pokrzywki, jeżeli podejrzewa się tło alergiczne, warto wykonać odpowiednie badania i testy. Zastosowanie w tej sytuacji znajdują takie testy diagnostyczne jak:
- punktowe testy skórne – pozwalają na identyfikację uczulającego alergenu wziewnego i/lub pokarmowego,
- oznaczenie stężenia IgE całkowitego i IgE swoistych – jest to badanie wykonywane z krwi,
- naskórkowe testy płatkowe – pozwalają na potwierdzenie uczulenia na alergeny kontaktowe,
- próby prowokacyjne z alergenami pokarmowymi lub lekami – powinny być wykonywane pod opieką lekarza, najlepiej w czasie hospitalizacji.

Uzupełniająco, w przebiegu diagnostyki przewlekłej pokrzywki alergicznej wykonuje się również dodatkowe badania laboratoryjne, które mają na celu identyfikację możliwych przyczyn tego stanu. W tym celu wykonuje się takie badania i oznaczenia laboratoryjne jak:
- morfologia krwi obwodowej,
- stężenie CRP oraz OB,
- badanie kału w kierunku obecności pasożytów i G. lamblia,
- badania w kierunku infekcji wywołanej przez Helicobacter pylori,
- oznaczenie przeciwciał anty-HCV,
- oznaczenie prób wątrobowych,
- panel tarczycowy – w tym stężenie TSH, fT3, fT4, a także przeciwciał przeciwtarczycowych anty-TG i anty-TPO,
- stężenie tryptazy,
- przeciwciała przeciwjądrowe,
- przeciwciała w kierunku boreliozy – w klasie IgG oraz IgM,
- wymazy mające na celu identyfikację ewentualnych ognisk infekcji – na przykład wymaz z gardła, wymaz z nosa.


>> Zobacz także: Nietolerancja histaminy czy alergia? Czym się różnią i dlaczego łatwo je pomylić?
Czy pokrzywka alergiczna jest groźna dla zdrowia?
Pokrzywka alergiczna może mieć przebieg kliniczny, który stanowi zagrożenie dla zdrowia, a czasami również życia pacjenta. W przypadku wystąpienia obrzęku naczynioruchowego może dojść do obrzęku w obrębie błony śluzowej krtani, co grozi dusznością i niewydolnością oddechową.
Zdarza się również, że pokrzywka może współtowarzyszyć wstrząsowi anafilaktycznemu, który jest bezpośrednim zagrożeniem życia i jest związany z groźnym spadkiem ciśnienia tętniczego. Pacjenci po takich incydentach powinni być zaopatrzeni we wstrzykiwacz z adrenaliną, którą można podać w takiej sytuacji domięśniowo.
Jak przeciwdziałać powstawaniu pokrzywki alergicznej?
Najważniejszym krokiem jest wnikliwa diagnostyka, która ma na celu identyfikację alergenów odpowiedzialnych za pojawienie się objawów. Jeżeli testy alergologiczne wykazały, który alergen odpowiada za pojawienie się zmian, to wówczas należy unikać narażenia na ten czynnik.
Należy być także świadomym istnienia reakcji krzyżowych, szczególnie między alergenami wziewnymi i pokarmowymi. Przykładem tego rodzaju reakcji jest reakcja pomiędzy brzozą a jabłkiem, oraz lateksem a bananami. Oznacza to, że pacjent uczulony na brzozę może wykazywać pojawienie się objawów chorobowych po spożyciu jabłka. Warto mieć przy sobie leki antyhistaminowe, ponieważ nie zawsze jesteśmy w stanie uniknąć narażenia, szczególnie na alergeny powietrznopochodne.
Pokrzywka alergiczna to jeden z rodzajów pokrzywki, w którym pojawienie się zmian chorobowych jest związane z narażeniem na pewne alergeny. Mimo wielu badań jakie możemy wykonać w diagnostyce tego schorzenia, nie zawsze udaje się zidentyfikować czynnik wywołujący objawy. Wynika to z faktu, że otaczają Cię tysiące alergenów i nie istnieją badania, wykrywające uczulenie na każdy z nich. Jeżeli zauważysz objawy mogące sugerować pokrzywkę alergiczną, udaj się na konsultację do lekarza specjalisty alergologa lub dermatologa.
Bibliografia
- A. Szczeklik, Piotr Gajewski, Interna Szczeklika, Wydawnictwo Medycyna Praktyczna, Kraków 2020/2021,
- L. Rudnicka i inni, Współczesna Dermatologia, PZWL, Warszawa 2022,
- L. Bolognia i inni, Fourth Edition Dermatologia, Medipage, Warszawa 2022,
- J. Kruszewski, R. Nowicki i inni, Pokrzywki – rozpoznawanie i leczenie. Stanowisko Panelu Ekspertów Polskiego Towarzystwa Alergologicznego, Medycyna Praktyczna, Kraków 2011.