AMH jest hormonem, który budzi zainteresowanie ze względu na swoją rolę w organizmie kobiety, gdzie określa poziom rezerwy jajnikowej. Dzięki temu można oszacować, jaki czas pozostał kobiecie na zostanie matką.
Jednak AMH występuje również u mężczyzn. Artykuł opisuje jaką pełni funkcję w męskim organizmie, jakie znaczenie może mieć badanie poziomu AMH u mężczyzny.
Spis treści:
- Hormon anty-mullerowski u mężczyny – rola w organizmie
- Hormon anty-mullerowski – kiedy wykonać badanie?
- Nieprawidłowe AMH u mężczyzny – o czym może świadczyć?
- Poziom AMH w zaburzeniach związanych z męską płodnością
- Na czym polega badanie poziomu AMH u mężczyzn? Jak przygotować się do badania?
- Hormon anty-mullerowski – podsumowanie
Hormon anty-mullerowski u mężczyzny – rola w organizmie
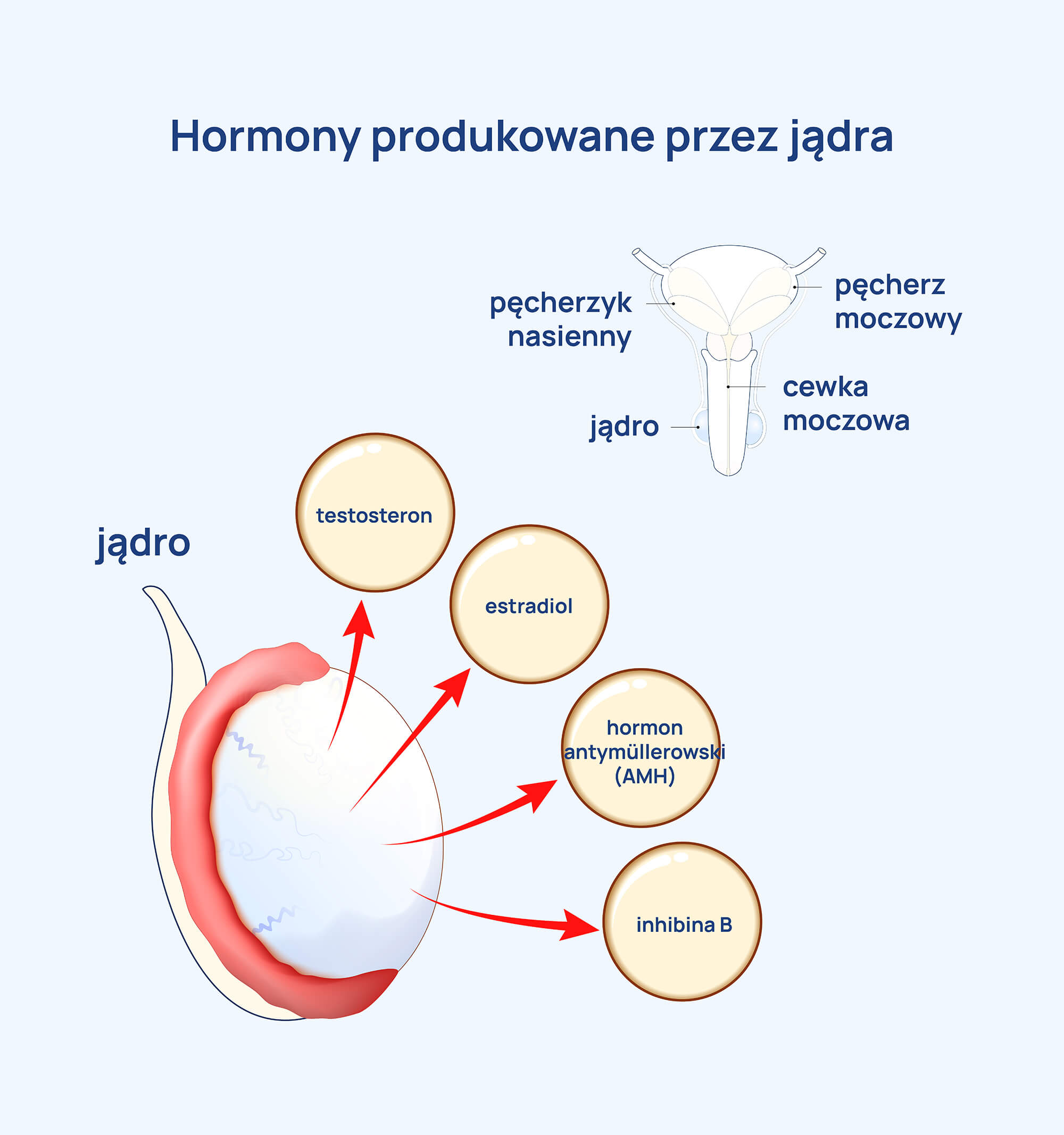
AMH w organizmie mężczyzny produkowany jest w jądrach przez komórki kanalika nasiennego, nazywane komórkami Sertolego, dlatego jest uznawany za funkcjonalny marker płodowych komórek Sertolego. Czynniki wydzielane przez te struktury biorą udział w spermatogenezie.
Produkcja AMH zaczyna się w okresie płodowym i trwa do okresu dojrzewania. Jego rolą w życiu płodowym jest regresja, czyli zahamowanie funkcji przewodów Müllera – stąd zresztą wzięła się jego nazwa.
>> Przeczytaj też: Krótkie kompendium wiedzy o dojrzewaniu płciowym
Przewody Müllera to parzysta struktura, z której – przy braku hamującego działania AMH i testosteronu – rozwijają się żeńskie, wewnętrzne narządy płciowe:
- jajowody,
- macica,
- górna część pochwy.
Natomiast w gonadach męskich, ok. 7 tygodnia ciąży, wysokie stężenie AMH powoduje regresję przewodów Müllera. Ulegają one uwstecznieniu, tworząc szczątkowe narządy męskiego układu płciowego (łagiewkę sterczową i przyczepek jądra).

W okresie przedpokwitaniowym u chłopców stężenie AMH pozostaje wysokie, obniża się w okresie dojrzewania. Jest to związane z nagłym wzrostem poziomu testosteronu, który ma hamujący wpływ na AMH. Poziom AMH u dorosłych mężczyzn obniża się wraz z wiekiem, jest niższy u starszych mężczyzn.
Hormon anty-mullerowski – kiedy wykonać badanie?
AMH jest hormonem, który umożliwia rozwój męskich narządów płciowych w życiu płodowym. Efektem jego zbyt niskiego stężenia, lub jego braku, jest równoczesny rozwój zarówno męskich, jak i żeńskich narządów płciowych. Dlatego oznaczanie stężenia AMH znajduje zastosowanie w przypadku niewłaściwej funkcji jąder u chłopców.

Nieprawidłowe AMH u mężczyzny – o czym może świadczyć?
- Zespół Klinefeltera
Bardzo niskie poziomy AMH (i testosteronu) mogą być wskaźnikiem zaburzeń pracy jąder u osób z zespołem Klinefeltera, cierpiących na upośledzoną spermatogenezę lub braku funkcjonalnej tkanki jąder u pacjentów z anorchią (osoby o kariotypie XY urodzone z bez jąder).
U pacjentów z zespołem Klinefeltera poziom krążącego AMH jest prawidłowy do okresu dojrzewania, niskie poziomu tego hormonu obserwuje się dopiero u osób dorosłych.
- Zespół przetrwałego przewodu Mullera (PMDS)
Prawidłowy poziom testosteronu i niewykrywalne AMH są charakterystyczne dla pacjentów z zespołem przetrwałego przewodu Mullera (PMDS). Pacjent rodzi się jako mężczyzna o kariotypie 46 XY. Jednak wskutek dysfunkcji wydzielania AMH nie zanika przewód Mullera, co objawia się niezstąpionymi jądrami (wnętrostwem), a także rozwojem macicy, jajowodów i górnej części pochwy.
Osoby z PMDS wykazują obecność męskiego i żeńskiego układu rozrodczego jednocześnie. Badania wskazują, iż 88% przypadków PMDS spowodowana jest mutacjami w genie AMH, pozostałe 12% to zaburzenia idiopatyczne, których pochodzenia na dziś nie znamy.
- Mieszane zaburzenia rozwoju płci (DSD)
Zbyt niskie stężenie AMH idące w parze ze zbyt niskim poziomem testosteronu występują u osób z mieszanymi zaburzeniami rozwoju płci (DSD).
- Żylaki powrózka nasiennego
Powrózek nasienny jest strukturą grupującą:
- nasieniowód,
- tętnice,
- splot żylny,
- nerwy wchodzące i wychodzące z moszny.
Żylaki powrózka nasiennego to powiększenie i nieprawidłowe wygięcie splotu żylnego. Rozszerzone żyłyupośledzają ukrwienie jąder,ograniczają dopływ krwi utlenowanej i zaopatrzonej w składniki odżywcze, co skutkuje spadkiem jakości i ilości plemników. Zaburza również regulację temperatury w jądrach, co także sprzyja niepłodności.
Żylaki powrózka nasiennego stwierdza się u ok. 35% mężczyzn z niepłodnością pierwotną i aż u 80% z niepłodnością wtórną.
Żylaki powrózka nasiennego mogą prowadzić do upośledzenia funkcji komórek Sertolego. U chłopców z żylakami powrózka nasiennego w okresie przedpokwitaniowym, stężenie AMH jest podwyższone, co wskazuje na kompensacyjny wzrost komórek Sertolego w przypadku żylaków o wczesnym początku. Badania wskazują, że poziomy krążącego AMH u dorosłych mężczyzn z niepłodnością są niższe niż w grupach kontrolnych.
>> Przeczytaj też: Niepłodność u mężczyzn: najczęstsze przyczyny, objawy i rozpoznanie. Leczenie niepłodności

Poziom AMH w zaburzeniach związanych z męską płodnością
Poziom AMH różni się u pacjentów z zaburzeniami płodności w zależności od ich przyczyny.
- Dojrzewanie opóźnione – poziom AMH w okresie dojrzewania jest taki sam jak w okresie przedpokwitaniowym.
- Wrodzony hipogonadyzm hipogonadotropowy – poziom AMH jest obniżony w okresie dojrzewania.
- Zespół Klinefeltera (47,XXY) – przed okresem dojrzewania poziom AHM jest prawidłowy, w czasie pokwitania notuje się opóźnienie spadku związanego z dojrzewaniem. U osób dorosłych z tym zespołem poziom AMH jest obniżony poniżej wartości referencyjnych.
- Żylaki powrózka nasiennego – podwyższony poziom AMH obserwuje się u pacjentów z żylakami o wczesnym początku w okresie przed dojrzewaniem i czasie dojrzewania. U dorosłych z ciężkimi żylakami powrózka poziom AMH jest zmniejszony.
- Zespół McCune’a-Albrighta – zwiększony poziom AMH notuje się u chłopców.
- Azoospermia – brak plemników w nasieniu – związana z uszkodzeniem czynności jąder – poziom AMH jest obniżony.
- Wiek – poziom AMH zmniejsza się z wiekiem, jest niż w wieku starszym.
>> Warto przeczytać też: Badania laboratoryjne w diagnostyce niepłodności

Na czym polega badanie poziomu AMH u mężczyzn? Jak przygotować się do badania?
Badanie poziomu AMH u mężczyzny polega na pobraniu krwi z żyły łokciowej. Badanie nie wymaga specjalnego przygotowania. Hormon anty-mullerowski nie wykazuje wahań poziomów dobowych, dlatego nie jest wymagane pobieranie krwi o określonej porze.
Hormon anty-mullerowski – podsumowanie
AMH u mężczyzn jest hormonem, który umożliwia rozwój męskich narządów płciowych w życiu płodowym. Oznaczanie poziomu AMH u mężczyzn może być pomocne w różnicowaniu przyczyn zaburzeń funkcjonowania jąder oraz przyczyn niepłodności.
Bibliografia
- https://podyplomie.pl/wiedza/wielka-interna/1238,podstawowe-wiadomosci-na-temat-meskiego-ukladu-rozrodczego. (dostęp 10.03.2025)
- Xu HY, Zhang HX, Xiao Z, Qiao J, Li R. Regulation of anti-Müllerian hormone (AMH) in males and the associations of serum AMH with the disorders of male fertility. Asian J Androl. 2019 Mar-Apr;21(2):109-114. doi: 10.4103/aja.aja_83_18. PMID: 30381580; PMCID: PMC6413543. (dostęp 10.03.2025)
- Jarząbek-Bielecka G., Znaczenie zaburzeń rozwoju płci gonadoforycznej w medycynie seksualnej., Seksuologia Polska 2012, 10, 2, 70–75 Copyright © 2012 Via Medica, ISSN 1731–6677. (dostęp 10.03.2025)
- Agrawal AS, Kataria R. Persistent Müllerian Duct Syndrome (PMDS): a Rare Anomaly the General Surgeon Must Know About. Indian J Surg. 2015 Jun;77(3):217-21. doi: 10.1007/s12262-013-1029-7. Epub 2014 Jan 3. PMID: 26246705; PMCID: PMC4522266. (dostęp 10.03.2025)