Plamica małopłytkowa to zaburzenie, w którym niska liczba płytek krwi prowadzi do skłonności do krwawień – m.in. wybroczyn czy siniaków. W artykule wyjaśniamy, jakie są jej rodzaje, objawy i metody leczenia. Dowiedz się, kiedy plamica może być groźna i kiedy konieczna jest pilna konsultacja lekarska.
Spis treści:
- Co to jest plamica małopłytkowa?
- Plamica małopłytkowa u dzieci
- Plamica małopłytkowa – jakie daje objawy?
- Diagnostyka plamicy małopłytkowej – jakie badania wykonać?
- Leczenie plamicy małopłytkowej
- Plamica małopłytkowa: odpowiedzi na najczęstsze pytania (FAQ)
- Plamica małopłytkowa: podsumowanie informacji
Co to jest plamica małopłytkowa?
Plamica małopłytkowa to rodzaj skazy krwotocznej, czyli stanu, w którym organizm ma zaburzoną zdolność do zatrzymywania krwawień. W tym przypadku przyczyną jest zmniejszona liczba płytek krwi (poniżej 100 × 10⁹/l), co prowadzi do pojawiania się wybroczyn, siniaków lub krwotoków śluzówkowych. Małopłytkowość to ogólny termin określający obniżoną liczbę płytek krwi, natomiast plamica odnosi się do sytuacji, w której temu niedoborowi towarzyszą objawy skazy krwotocznej. Choroba może mieć różnorodne przyczyny — od procesów immunologicznych, przez infekcje, aż po choroby nowotworowe układu krwiotwórczego.
>> Zobacz również: Co to jest trombofilia i jakie są jej rodzaje? Przyczyny trombofilii
Zakrzepowa plamica małopłytkowa
Zakrzepowa plamica małopłytkowa (TTP, ang. thrombotic thrombocytopenic purpura; w klasyfikacji ICD-10 oznaczona kodem D69.4) to rzadka, ale ciężka choroba, w której powstają zakrzepy w drobnych naczyniach krwionośnych. Prowadzi to do niedokrwienia narządów i obniżenia liczby płytek. Objawy to m.in. wybroczyny, krwawienia, gorączka, niedokrwistość i zaburzenia neurologiczne. TTP wymaga natychmiastowego leczenia specjalistycznego.
Immunologiczna plamica małopłytkowa
Małopłytkowość immunologiczna (ITP, ang. Immune Thrombocytopenia, ICD-10: D69.3), wcześniej nazywana idiopatyczną plamicą małopłytkową, to częsta przyczyna nabytej małopłytkowości. Układ odpornościowy niszczy płytki krwi, czasem także zaburzając ich produkcję. Może mieć postać pierwotną (bez uchwytnej przyczyny) lub wtórną – towarzyszącą innym chorobom.
- Pierwotna małopłytkowość immunologiczna (samoistna plamica małopłytkowa)
Rozpoznanie ustala się po wykluczeniu innych możliwych przyczyn małopłytkowości. Choroba częściej dotyczy dorosłych kobiet i może przebiegać bezobjawowo lub objawiać się skazą krwotoczną – np. wybroczynami, krwawieniami z dziąseł czy przedłużonymi miesiączkami.
- Wtórna małopłytkowość immunologiczna
Może być następstwem infekcji wirusowych (takich jak HIV czy HCV), chorób autoimmunologicznych (np. toczeń układowy), nowotworów układu krwiotwórczego, działania niektórych leków lub wrodzonych niedoborów odporności. Zwykle towarzyszy innym jednostkom chorobowym i może mieć zróżnicowany przebieg – od bezobjawowego do pełnoobjawowej skazy krwotocznej.
Plamica małopłytkowa u dzieci
U dzieci plamica małopłytkowa najczęściej występuje w postaci pierwotnej małopłytkowości immunologicznej (ITP). Zazwyczaj pojawia się po przebytej infekcji wirusowej i ma łagodny przebieg. Objawy najczęściej ustępują samoistnie w ciągu kilku tygodni lub miesięcy.
W większości przypadków wystarczająca jest obserwacja, choć przy nasilonych krwawieniach może być konieczne leczenie.
| Zakrzepowa plamica małopłytkowa (TTP) u dzieci występuje bardzo rzadko, ale jest stanem nagłym i wymaga pilnej interwencji medycznej. |
Plamica małopłytkowa – jakie daje objawy?
Objawy pojawiają się, gdy liczba płytek krwi spada poniżej normy i organizm nie jest w stanie skutecznie tamować drobnych krwawień (czyli zaburzenie mechanizmów krzepnięcia, tzw. hemostazy). Ich nasilenie zależy od poziomu płytek oraz indywidualnej reakcji organizmu.
Najczęstsze objawy plamicy to:
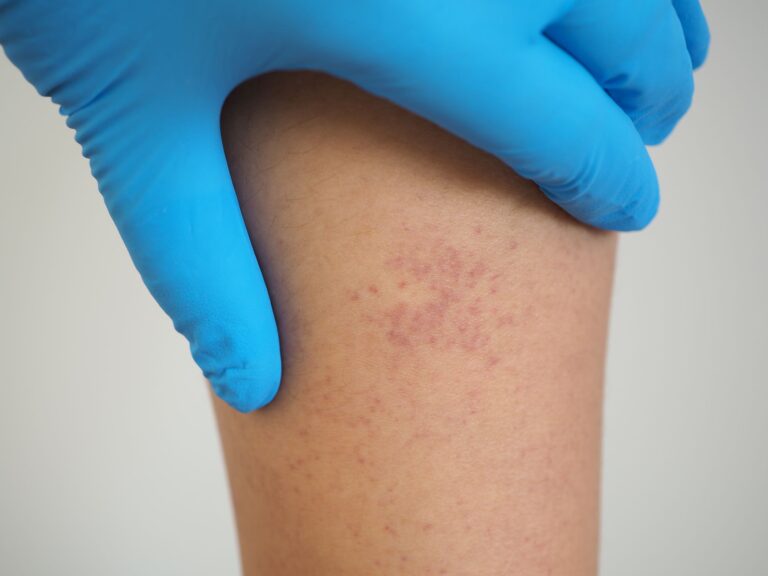
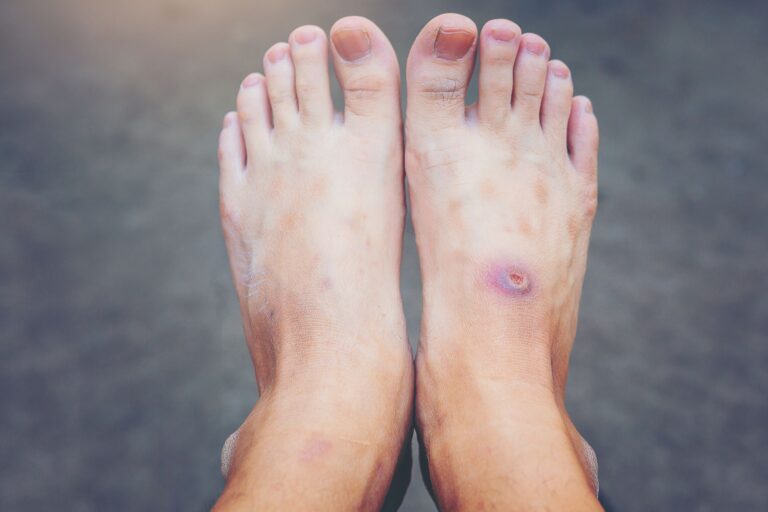
- wybroczyny (małe czerwone punkty na skórze),
- siniaki bez urazu,
- krwawienia z dziąseł i nosa,
- przedłużone lub obfite miesiączki,
- obecność krwi w moczu lub stolcu,
- uczucie zmęczenia.
W niektórych postaciach choroby, zwłaszcza przy zakrzepowej plamicy małopłytkowej (TTP), mogą wystąpić także objawy neurologiczne, takie jak bóle głowy, zaburzenia mowy czy drgawki.
Każdy z tych objawów wymaga diagnostyki i odpowiedniego leczenia, zwłaszcza jeśli towarzyszy im niska liczba płytek.
>> Przeczytaj również: Kiedy krwawienie z nosa powinno budzić obawy?
Diagnostyka plamicy małopłytkowej – jakie badania wykonać?
Plamica małopłytkowa to objaw, który może mieć wiele przyczyn, dlatego diagnostyka skupia się na określeniu liczby płytek krwi i ustaleniu źródła zaburzenia – immunologicznego, infekcyjnego lub zakrzepowego.

Podstawą rozpoznania jest morfologia krwi, często uzupełniona o rozmaz mikroskopowy. W zależności od podejrzenia lekarz może zlecić również:
- ocenę aktywności enzymu ADAMTS13 (w kierunku TTP),
- oznaczenie poziomu LDH (dehydrogenazy mleczanowej), który może być podwyższony w zakrzepowej plamicy małopłytkowej (TTP),
- badania w kierunku infekcji (HIV, HCV, Helicobacter pylori),
- testy autoimmunologiczne (np. ANA, antyfosfolipidowe),
- ocenę funkcji nerek i parametrów krzepnięcia.

W rzadkich przypadkach wykonuje się także badanie szpiku. Dobór badań zależy od objawów i podejrzewanego typu plamicy.
Leczenie plamicy małopłytkowej
Leczenie plamicy zależy od jej rodzaju i nasilenia objawów. Niektóre postacie wymagają szybkiej interwencji szpitalnej, inne – jedynie obserwacji.
- Leczenie zakrzepowej plamicy małopłytkowej (TTP):
TTP to stan zagrożenia życia. Podstawą terapii jest plazmafereza, czyli zabieg oczyszczania krwi z autoprzeciwciał. Wspomagająco stosuje się leki immunosupresyjne i niekiedy nowoczesne terapie celowane.
- Leczenie małopłytkowości immunologicznej (ITP):
Postępowanie zależy od ciężkości objawów. W łagodnych przypadkach wystarcza obserwacja, w nasilonej skazie stosuje się:- glikokortykosteroidy,
- dożylne immunoglobuliny (IVIG),
- leczenie choroby podstawowej (w ITP wtórnej),
- leki drugiego rzutu, gdy objawy nawracają.
| Ważne jest też unikanie leków pogarszających funkcję płytek (np. aspiryny). |
Plamica małopłytkowa: odpowiedzi na najczęstsze pytania (FAQ)
To zależy od jej rodzaju. Zakrzepowa plamica małopłytkowa (TTP) może być stanem zagrażającym życiu i wymaga pilnego leczenia szpitalnego. Z kolei immunologiczna małopłytkowość (ITP) u wielu osób przebiega łagodnie i pozwala na normalne funkcjonowanie, choć w niektórych przypadkach może wymagać długoterminowego leczenia.
Płytki krwi odgrywają kluczową rolę w procesie krzepnięcia. Kiedy ich liczba spada poniżej normy, organizm nie radzi sobie z tamowaniem nawet drobnych krwawień, co prowadzi do powstawania wybroczyn, siniaków i innych objawów skazy krwotocznej.
Przyczyn plamicy małopłytkowej jest wiele. Może ona wynikać z reakcji autoimmunologicznej (jak w ITP), niedoboru enzymów uczestniczących w krzepnięciu (jak w TTP), infekcji, działania niektórych leków, chorób nowotworowych lub mieć charakter idiopatyczny – czyli bez uchwytnej przyczyny.
Plamica małopłytkowa: podsumowanie informacji
- To grupa chorób, w których obniżona liczba płytek krwi prowadzi do objawów skazy krwotocznej (np. wybroczyn, siniaków, krwawień).
- Najczęściej występujące typy to: małopłytkowość immunologiczna (pierwotna i wtórna) oraz zakrzepowa plamica małopłytkowa.
- Zakrzepowa plamica małopłytkowa (TTP) jest stanem nagłym i wymaga szybkiego leczenia szpitalnego.
- Małopłytkowość immunologiczna (ITP) często ma łagodny przebieg i może ustępować samoistnie, zwłaszcza u dzieci.
- Diagnostyka obejmuje badania krwi (morfologia, aktywność ADAMTS13), testy infekcyjne i immunologiczne.
- Leczenie zależy od przyczyny i stopnia nasilenia objawów – od obserwacji po leczenie immunosupresyjne lub plazmaferezę.
- Każdy przypadek wymaga indywidualnego podejścia i oceny ryzyka powikłań.
Bibliografia
- Interna Szczeklika. Mały podręcznik 2025. Rozdział: Małopłytkowość immunologiczna. Windyga J. i wsp.
- mp.pl: Małopłytkowość immunologiczna. Karkosz A.
- mp.pl: Zakrzepowa plamica małopłytkowa. Karkosz A.
- Arnold DM, Cuker A. Immune thrombocytopenia (ITP) in adults: Clinical manifestations and diagnosis. UpToDate.