W dermatologii wyróżniamy kilka odmian tocznia skórnego, w zależności od głębokości nacieku zapalnego i obrazu klinicznego zmian skórnych. Jedną z nich jest toczeń rumieniowaty krążkowy.
Z tego artykułu dowiesz się:
- Co to jest toczeń rumieniowaty krążkowy?
- Jak objawia się toczeń rumieniowaty krążkowy?
- Jakie badania wykonuje się w trakcie diagnostyki tocznia rumieniowatego krążkowego?
- Na czym polega leczenie tocznia rumieniowatego krążkowego?
Spis treści:
- Czym jest toczeń rumieniowaty krążkowy?
- Kogo najczęściej dotyka toczeń krążkowy?
- Objawy tocznia rumieniowatego krążkowego
- Przyczyny i czynniki ryzyka rozwoju tocznia krążkowego
- Diagnostyka tocznia rumieniowatego krążkowego – jakie badania wykonać?
- Diagnostyka różnicowa tocznia rumieniowatego krążkowego
- Leczenie tocznia rumieniowatego krążkowego
- Toczeń rumieniowaty krążkowy – podsumowanie
Czym jest toczeń rumieniowaty krążkowy?
Toczeń rumieniowaty krążkowy (discoid lupus erythematosus, DLE) to jedna z postaci tocznia skórnego, w której mamy do czynienia z naciekami komórek zapalnych lokalizujących się w obrębie naskórka, skóry właściwej, a także w okolicy okołoprzydatkowej (między innymi wokół mieszków włosowych, czy gruczołów potowych). Wyróżniamy dwie odmiany tocznia rumieniowatego krążkowego, a mianowicie:
- postać ograniczoną – zmiany pojawiają się powyżej linii karku,
- postać rozsianą– w tym przypadku zmiany mogą pojawiać się w różnych lokalizacjach, również poniżej linii karku,
- postać przerostową – w jej przebiegu obserwuje się grubo nawarstwioną łuskę, która może pokrywać całą powierzchnię zmiany krążkowej lub tylko obwód.
Kogo najczęściej dotyka toczeń krążkowy?
Toczeń rumieniowaty krążkowy to schorzenie przewlekłe, które częściej diagnozowane jest u kobiet, a także u pacjentów z predyspozycją genetyczną do schorzeń autoimmunologicznych. Czynniki ryzyka wystąpienia omawianego w tym artykule schorzenia zostaną przedstawione w kolejnych akapitach.
>> Przeczytaj także: Choroby autoimmunologiczne – czym są? Objawy, diagnostyka i leczenie
Objawy tocznia rumieniowatego krążkowego
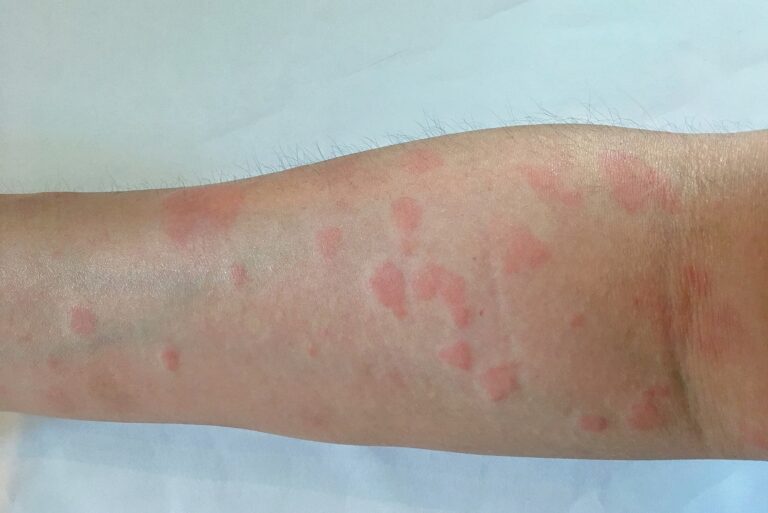
Zmiany skórne w przebiegu tocznia rumieniowatego krążkowego to przede wszystkim wykwity rumieniowo-naciekowe, z charakterystyczną szorstką powierzchnią. Z czasem w części centralnej wykwitów pojawia się zanik o charakterze bliznowatym (są to zmiany typowo nieodwracalne i istotnie pogarszające jakość życia pacjentów). Zmiany chorobowe rzadko mogą zajmować błonę śluzową jamy ustnej, nosa, czy okolicę narządów płciowych. Wykwity lokalizują się zarówno w miejscach eksponowanych na światło słoneczne, ale nie tylko. Towarzyszą im zaburzenia pigmentacji pod postacią odbarwień w centrum zmian i przebarwień na ich obwodzie.
Najczęstsze lokalizacje zmian w przebiegu tocznia rumieniowatego krążkowego to:
- twarz,
- małżowiny uszne,
- owłosiona skóra głowy – pojawią się w tym miejscu ogniska łysienia bliznowaciejącego,
- okolice karku.
Przyczyny i czynniki ryzyka rozwoju tocznia krążkowego
Toczeń rumieniowaty krążkowy to schorzenie o podłożu autoimmunologicznym i niezwykle złożonej etiopatogenezie. Czynniki ryzyka wystąpienia tej skórnej postaci tocznia rumieniowatego to przede wszystkim:
- płeć żeńska,
- pochodzenie etniczne – schorzenie częściej rozwija się u Afroamerykanów i Latynosów,
- narażenie na promieniowanie ultrafioletowe,
- predyspozycje genetyczne,
- czynniki hormonalne – przyjmowanie antykoncepcji hormonalnej, czy hormonalnej terapii zastępczej,
- przyjmowanie niektórych leków – w tym prokainamidu, hydralazyny, izoniazydu,
- czynniki infekcyjne – między innymi wirus EBV, zakażenia bakteryjne.
Diagnostyka tocznia rumieniowatego krążkowego – jakie badania wykonać?
W diagnostyce tocznia rumieniowatego krążkowego i w celu wykluczenia zajęcia narządów wewnętrznych wykorzystuje się przede wszystkim takie procedury i badania laboratoryjne jak:
- szczegółowo przeprowadzony wywiad chorobowy i badanie przedmiotowe pacjenta, w tym badanie skóry i błon śluzowych,
- badanie dermatoskopowe zmian skórnych,
- morfologia krwi obwodowej,
- stężenie CRP,
- oznaczenie OB,
- stężenie kreatyniny,
- próby wątrobowe,
- oznaczenie przeciwciał przeciwjądrowych ANA,
- badanie histopatologiczne wycinka skóry,
- badanie immunopatologiczne wycinka skóry – klasycznie widoczne są złogi przeciwciał IgG i/lub IgM na granicy skórno-naskórkowej i wokół mieszków włosowych,
- oznaczenie składowych C4 i C3 dopełniacza,
- badania obrazowe – w przypadku podejrzenia postaci układowej warto wykonać między innymi RTG klatki piersiowej, ECHO serca, USG jamy brzusznej.

>> Warto przeczytać: Badanie histopatologiczne – co to jest, co wykrywa i kiedy się je przeprowadza?
Pacjenci z toczniem rumieniowatym krążkowym i przewlekłymi zmianami skórnymi w jego przebiegu wymagają regularnych kontroli dermatologicznych, ponieważ w obrębie tych wykwitów może dojść do rozwoju raka kolczystokomórkowego (SCC). Istnieje również ryzyko rozwoju układowej postaci tocznia rumieniowatego (SLE), które wynosi około 10-20%. Ryzyko to jest wyższe w rozsianej postaci tocznia rumieniowatego krążkowego.
Diagnostyka różnicowa tocznia rumieniowatego krążkowego
Jakie inne schorzenie dermatologiczne mogą przypominać swoim obrazem klinicznym toczeń rumieniowaty krążkowy? Należy pomyśleć przede wszystkim o takich jednostkach chorobowych jak:
- wyprysk pieniążkowaty,
- mucynoza mieszkowa,
- ziarniniak obrączkowaty,
- wielopostaciowe osutki świetlne,
- gruźlica skóry,
- grzybice skóry – szczególnie wywołane przez grzyby dimorficzne,
- liszaj płaski mieszkowy,
- sarkoidoza,
- nieczerniakowe nowotwory złośliwe skory – w przypadku pojedynczej zmiany.
Leczenie tocznia rumieniowatego krążkowego
Sposób leczenia tocznia rumieniowatego krążkowego zależy przede wszystkim od nasilenia zmian skórnych, jak i schorzeń towarzyszących. W terapii tego schorzenia dermatologicznego zastosowanie znajdują:
- miejscowe glikokortykosteroidy – w postaci kremu, maści,
- doogniskowo podawany triamcynolon,
- miejscowe inhibitory kalcyneuryny – na przykład takrolimus,
- leki antymalaryczne – w tym hydroksychlorochina, chlorochina, chinakryna,
- acytretyna – zaliczana do retinoidów,
- glikokortykosteroidy podawane doustnie,
- ochrona przeciwsłoneczna – jest to szczególnie ważne mając na uwadze fakt zwiększonego ryzyka rozwoju raka kolczystokomórkowego.
Toczeń rumieniowaty krążkowy – podsumowanie
- Toczeń rumieniowaty krążkowy to schorzenie o podłożu autoimmunologicznym, które w większości przypadków manifestuje się wyłącznie na skórze.
- W obrazie kliniczny tocznia rumieniowatego krążkowego dominują zmiany rumieniowo-naciekowe, przechodzą w zmiany bliznowate.
- W diagnostyce tocznia rumieniowatego krążkowego wykonuje się badania laboratoryjne, histopatologiczne, immunopatologiczne, jak i obrazowe.
- Leczenie tocznia rumieniowatego układowego polega na stosowaniu preparatów w postaci zewnętrznej, ale również leków ogólnoustrojowych. O rodzaju terapii decyduje lekarz prowadzący.
Bibliografia
- M. Dec, H. Arasiewicz, Toczeń rumieniowaty krążkowy i rak kolczystokomórkowy skóry, Dermatologia w Praktyce Klinicznej, 2024, t. 2, nr 1, s. 20–25,
- M S. Fernandes i inni, Discoid lupus erythematosus with squamous cell carcinoma: a case report and review of the literature in Indian patients. Lupus. 2015; 24(14): 1562–1566, doi: 10.1177/0961203315599245, indexed in Pubmed: 26251401,
- L. Rudnicka i inni, Współczesna Dermatologia, PZWL, Warszawa 2022.