Artykuł przybliża zagadnienie infekcji bakterią Clostidioides difficile, która jest w Polsce najczęstszą przyczyną zakażeń szpitalnych. Do zakażenia może dojść również w środowisku pozaszpitalnym. Kto jest najbardziej narażony na chorobę? Jak ją zdiagnozować? Czy możliwe jest całkowite wyleczenie infekcji? Zachęcamy do lektury tekstu, który daje odpowiedź na powyższe pytania.
| Kluczowe informacje: >> C.difficile jest bakterią beztlenową, powodującą infekcje jelitowe o różnym nasileniu. >> Głównym objawem klinicznym infekcji C.difficile jest wodnista biegunka. >> Najczęstszą przyczyną biegunki o etiologii C.difficile jest antybiotykoterapia. >> Najcięższą postacią zakażenia C.difficile jest pseudobłoniaste zapalenie okrężnicy, które może prowadzić do niedrożności jelit i rozdęcia okrężnicy. >> Badania laboratoryjne w kierunku C.difficile należy wykonać u pacjentów z biegunką, którzy w ostatnim czasie przyjmowali antybiotyki, byli hospitalizowani lub wcześniejsze badania w kierunku różnych innych enteropatogenów dały wynik ujemny. >> Dla uzyskania wiarygodnego potwierdzenia zakażenia C.difficile należy wykonać kompleksowe badanie laboratoryjne kału biegunkowego obejmujące wykrycie bakterii i potwierdzenie wytwarzania przez nie toksyny. >> Choroba wywoływana przez C.difficile jest uleczalna, a metoda terapii dobierana jest przez lekarza w zależności od postaci i przebiegu infekcji. >> Profilaktyka zakażenia C.difficile obejmuje izolację chorych, utrzymywanie reżimu sanitarnego w ich otoczeniu, dbanie o higienę osobistą (częste mycie rąk mydłem). |
Spis treści:
- Czym jest Clostridioides difficile?
- Jakie są przyczyny zakażenia Clostridioides difficile?
- W jakiś sposób można zarazić się Clostridioides difficile?
- Jak przebiega zarażenie Clostridioides difficile?
- Clostridioides difficile – objawy
- Jak rozpoznać Clostridioides difficile? Niezbędne badania laboratoryjne
- Jakie badania pozwalają zdiagnozować Clostridioides difficile?
- Jak przygotować próbkę kału do badania?
- Wynik ujemny lub dodatni badania – interpretacja wyników badań
- Clostridioides difficile – leczenie: przebieg, wytyczne i czas trwania
- Dieta przy Clostridioides difficile: co jeść, a czego unikać?
- Jak uniknąć zakażenia Clostridioides difficile? Wskazówki dotyczące profilaktyki
- Clostridioides difficile – sekcja FAQ
Czym jest Clostridioides difficile?
Clostridioides difficile to nowa nazwa gatunkowa bakterii Clostridium difficile. Zmianę nazwy wprowadzono w 2016 roku ze względu na różnice taksonomiczne z innymi drobnoustrojami z rodzaju Clostridium. Obecnie w powszechnym użyciu są obie formy oraz ich skrótowa nazwa C.difficile.
Drobnoustroje z gatunku C.difficile są bezwzględnymi beztlenowcami (nie rosną w obecności tlenu) zdolnymi do wytwarzania spor. Spory są oporne na działanie wysokich temperatur, kwasów, alkoholowych środków dezynfekcyjnych oraz na działanie większości antybiotyków. W naturalnych warunkach bakterie bytują w wodzie, glebie i przewodzie pokarmowym ludzi i zwierząt. Bezobjawowe nosicielstwo C.difficile u ludzi zdrowych jest rzadkie (ok. 3%), wyjątek stanowią niemowlęta, u których kolonizacja może sięgać powyżej 50%.
Bakterie w określonych warunkach mogą stać się przyczyną uszkodzenia jelita grubego, którego efektem jest biegunka o różnym nasileniu (CDAD – ang. Clostridium difficile associated disease).
>> Może Cię zainteresować: Biegunka bakteryjna – jak ją rozpoznać? Objawy, przyczyny i leczenie
Jakie są przyczyny zakażenia Clostridioides difficile?
Czynnikami ryzyka rozwoju zakażenia Clostridioides difficile są:
- antybiotykoterapia – główny czynnik ryzyka, szczególnie przy wydłużonej terapii oraz stosowaniu antybiotyków o szerokim spektrum działania (np. fluorochinolonów, cefalosporyn III generacji, aminopenicylin z inhibitorami). Objawy infekcji mogą wystąpić przy aktualnym, albo niedawno zakończonym leczeniu.
- wiek – prawdopodobieństwo choroby wzrasta z wiekiem, często infekcja dotyczy osób po 65. r.ż.
- hospitalizacja– ryzyko kolonizacji u chorych przebywających co najmniej 5 dni w szpitalu wzrasta do 50%.
- pobyt w DPS (Domu Pomocy Społecznej) lub ZOL (Zakładzie Opiekuńczo-Leczniczym).
- współistniejące ciężkie choroby podstawowe, w tym mające wpływ na spadek odporności.
- stosowanie inhibitorów pompy protonowej (IPP), hamujących wydzielanie kwasu solnego w żołądku.
- sondy dożołądkowe.
- zabiegi chirurgiczne w obrębie jamy brzusznej.
Za wirulencję (zjadliwość) laseczek C.difficile odpowiadają dwie toksyny. Toksyna A wykazuje działanie enterotoksyczne, toksyna B działa cytotoksycznie. Dodatkowo niewielki procent szczepów wytwarza toksynę binarną (CDT), która zwiększa ryzyko ciężkiego przebiegu zakażenia.
W Polsce toksynotwórcze szczepy Clostridioides difficile znalazły się na liście patogenów alarmowych. Szczególnie niebezpieczne są hiperepidemiczne szczepy NAP1/BI/027 charakteryzujące się zwiększoną produkcją toksyn A i B, wytwarzaniem toksyny binarnej, dużą zdolnością sporulacji oraz zmniejszoną wrażliwością na metronidazol i opornością na fluorochinolony.
Szczepy nie wytwarzające toksyn nie są przyczyną choroby.

W jakiś sposób można zarazić się Clostridioides difficile?
Rezerwuarem C.difficile są:
- środowisko człowieka: woda, gleba,
- zwierzęta domowe, dzikie, ptactwo,
- zdrowe noworodki i niemowlaki do 1 r.ż. (nosicielstwo u ok. 50%) – liczba bakterii i stężenie toksyn w kale noworodka jest porównywalna z wartościami w ciężkich przypadkach zakażenia u dorosłych,
- zdrowi dorośli (nosicielstwo u ok. 3%),
- chorzy po antybiotykoterapii bez biegunki,
- chorzy z biegunką poantybiotykową.
Do zakażenia Clostridioides difficile dochodzi drogą fekalno-oralną. Zakażeniu sprzyja nieprzestrzeganie zasad higieny osobistej i brak dbałości o czystość otoczenia.
W warunkach szpitalnych wpływ na pojawienie się infekcji ma:
- zagęszczenie pacjentów,
- wspólne toalety,
- długi okres hospitalizacji,
- brak izolatek,
- występowanie szczepów hiperwirulentnych,
- brak stosowania właściwych środków dezynfekcyjnych.
Zakażenia szpitalne szerzą się poprzez kontakt z zakażonym pacjentem (objawowym i bezobjawowym), zanieczyszczone przedmioty i sprzęt medyczny oraz poprzez ręce personelu.
Jak przebiega zarażenie Clostridioides difficile?
Bezpośrednią przyczyną nadmiernego namnażania się C.difficile w przewodzie pokarmowym jest zaburzenie równowagi mikrobioty jelitowej, np. na skutek antybiotykoterapii bądź zabiegów wykonywanych w obrębie jamy brzusznej.
Zniszczenie naturalnej bariery ochronnej jelit jest szansą dla rozrostu opornych na większość antybiotyków laseczek C.difficile. Objawy kliniczne infekcji występują jedynie w przypadku zakażenia szczepami toksynotwórczymi. Okres wylęgania choroby wynosi ok. 2-3 dni, może być wydłużony. Wytwarzana przez bakterie enterotoksyna stymuluje neutrofile do uwalniania cytokin prozapalnych i indukuje wzrost przepuszczalności bariery nabłonka, czego następstwem jest biegunka.
Cytotoksyna uszkadza komórki nabłonkowe, prowadząc do ich śmierci. Biegunka poantybiotykowa u wielu chorych przebiega łagodnie z samoistnym ustąpieniem po 5-10 dniach od zakończenia kuracji antybiotykiem. U ok. 25% pacjentów obserwowane są nawroty choroby. U pacjentów z grupy ryzyka może dojść do rozwoju rzekomobłoniastego zapalenia okrężnicy.
Clostridioides difficile (Clostridium difficile) – objawy
Zakażenie C.difficile może przebiegać bezobjawowo lub może dawać objawy biegunki o różnym nasileniu. Kał jest płynny, rzadko obecna jest w nim krew i śluz. Wypróżnienia mogą pojawiać się nawet do 30 x na dobę. Biegunce towarzyszą kurczowe bóle brzucha, gorączka, leukocytoza.
Najcięższą postacią zakażenia C.difficile (Clostridium difficile) jest rzekomobłoniaste zapalenie okrężnicy, które może prowadzić do niedrożności jelit i rozdęcia okrężnicy (toxic megacolon).
Objawy w przebiegu rzekomobłoniastego zapalenia okrężnicy obejmują (w nawiasach częstość występowania):
- biegunkę wodnistą (90-95%),
- biegunkę krwotoczną (5-10%),
- gorączkę (80%),
- leukocytozę (80%),
- ból brzucha (80-90%),
- objaw Blumberga (10-20%).
>> Może Cię zainteresować: Bulgotanie (przelewanie) w brzuchu i wodnista biegunka – przyczyny i zapobieganie
Jak rozpoznać Clostridioides difficile? Niezbędne badania laboratoryjne
Rozpoznanie zakażenia C.difficile opiera się na:
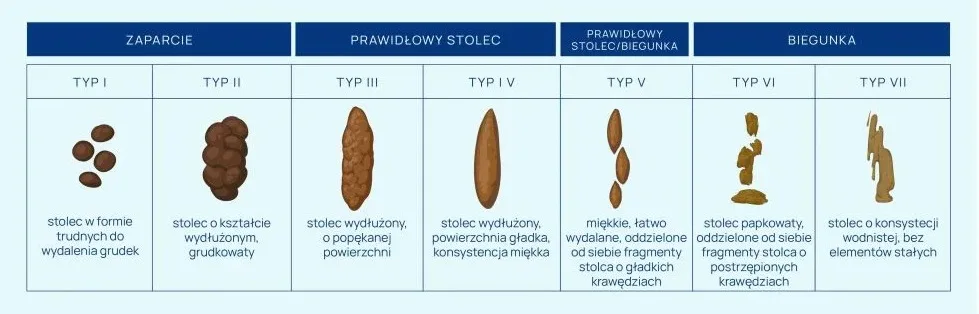
- stwierdzeniu objawów klinicznych, tj. biegunki (w ciągu 24 godzin ≥3 luźnych stolców, dopasowujących się kształtem do pojemnika lub odpowiadających typom 5-7 w skali Bristol) potwierdzonych wynikami badań mikrobiologicznych
- wykryciu megacolon toxicum (okrężnica olbrzymia – patologiczne poszerzenie jelita grubego potwierdzone radiologicznie) bez innej ustalonej przyczyny,
- spełnieniu co najmniej jednego z poniższych kryteriów:
- stwierdzenie obecności toksyn A i/lub B w stolcu lub wykazanie obecności szczepu C. difficile produkującego toksynę/y w posiewie kału lub przy zastosowaniu innych metod (np. wykrycie w kale genów kodujących toksyny A, B lub toksynę binarną C. difficile metodami amplifikacji kwasów nukleinowych NAAT, ang. Nucleic Acid Amplification Tests),
- stwierdzenie rzekomobłoniastego zapalenia jelit (colitis pseudomembranosa) w badaniu endoskopowym lub w trakcie zabiegu,
- stwierdzenie rzekomobłoniastego zapalenia jelit w badaniu histopatologicznym.

Jakie badania pozwalają zdiagnozować Clostridioides difficile?
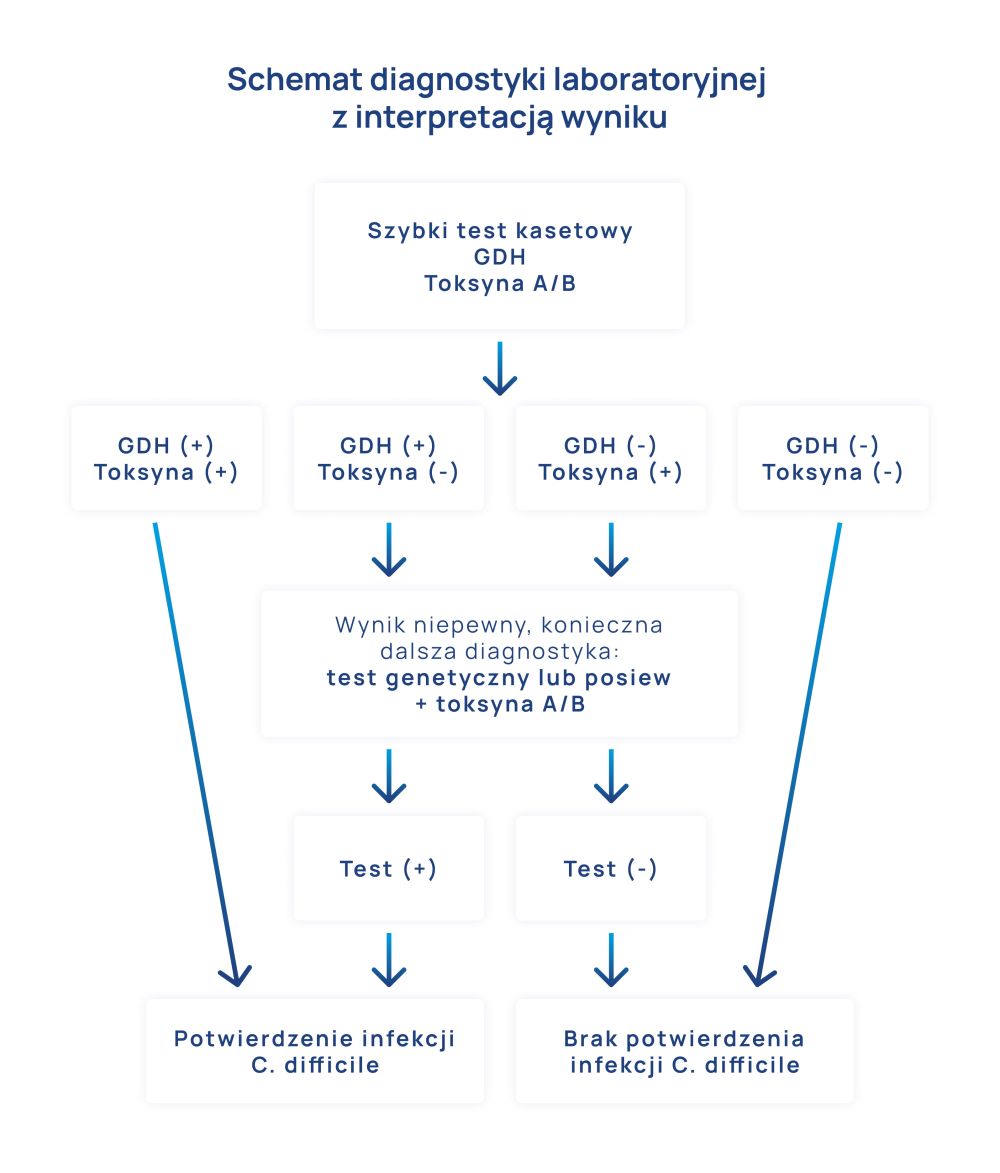
Podstawowym badaniem laboratoryjnym w kierunku diagnozowania CDAD jest badanie próbki kału na obecność bakterii C.difficile i ich toksyn. Stosowane są testy antygenowe (np. szybki test kasetkowy), testy molekularne oraz posiew mikrobiologiczny. Istotne jest wykonanie kompleksowego badania, które wykaże zarówno obecność komórek bakteryjnych jak i potwierdzi ich zdolność do wytwarzania toksyn. W szybkich testach antygenowych potwierdzeniem obecności bakterii jest dodatni test w kierunku enzymu GDH (dehydrogenaza glutaminianowa), który jest wytwarzany przez wszystkie szczepy C.difficile.
Metoda posiewu mikrobiologicznego umożliwia wyhodowanie bakterii. Dodatni wynik GDH i posiewu mikrobiologicznego musi być uzupełniony testem w kierunku wytwarzania toksyn, ponieważ szczepy nietoksyczne nie są chorobotwórcze. Z epidemiologicznego punktu widzenia ważne jest wykonanie badania w kierunku wykrycia szczepów hiperepidemicznych. (Schemat postępowania przedstawiono na rys.2. w dalszej części artykułu)
Wskazania do wykonania badań:
- Pacjent z biegunką , który jest lub był leczony antybiotykami 2-10 tyg. wcześniej.
- Pacjent z luźnymi stolcami o potencjalnie infekcyjnych przyczynach, u którego diagnostyka w kierunku innych enteropatogenów jest ujemna (niezależnie od wieku, stosowania antybiotyków, schorzeń towarzyszących)
- Wszyscy pacjenci, u których wystąpiła biegunka >48h od przyjęcia do szpitala.
- Pacjenci z biegunką, którzy byli hospitalizowani w ciągu ostatnich 3 miesięcy.
Jak przygotować próbkę kału do badania?
Kał biegunkowy należy pobierać jest do sterylnego naczynka kałowego i przekazać bez zbędnej zwłoki do laboratorium. Nie należy pobierać stolca uformowanego ani wykonywać wymazów z odbytu, gdyż taki materiał nie nadaje się do oceny. Kał kwalifikujący się do badania opisany jest jako typ 5-7 w skali Bristol rys 1.
Wynik ujemny lub dodatni badania – interpretacja wyników badań
Prawidłowa interpretacja wyniku badania w kierunku wykrycia zakażenia C.difficile (Clostridium difficile) wymaga wykonania kompleksowego badania diagnostycznego. Schemat postępowania z interpretacją wyniku przedstawiono na rys. 2.
Clostridioides difficile – leczenie: przebieg, wytyczne i czas trwania
Metoda leczenie zakażenia C.difficile (Clostridium difficile) zależna jest od postaci choroby. Przy lekkiej biegunce poantybiotykowej w pierwszej kolejności odstawiany jest lek, który był najprawdopodobniej przyczyną nadmiernego namnożenia toksynotwórczych szczepów C.difficile.
Jeżeli konieczna jest w dalszym ciągu terapia pierwotnej choroby zakaźnej najczęściej następuje zamiana antybiotyku na inny, o którym wiadomo, że przy jego zastosowaniu ryzyko wystąpienia rzekomobłoniastego zapalenia jelit jest mniejsze. W cięższych przypadkach CDAD stosowane jest leczenie celowane. Podawany jest metronidazol, wankomycyna i fidaksomycyna. Standardowe leczenie trwa 10-14 dni. Przy nawrotach infekcji można rozważyć przeszczep mikrobioty jelitowej od osoby zdrowej.
Dieta przy Clostridioides difficile: co jeść, a czego unikać?
Przy zakażeniu C.difficile należy unikać produktów niekorzystnie wpływających na perystaltykę jelit, takich jak:
- potrawy smażone,
- tłuste,
- ostro przyprawione,
- słodycze,
- napoje gazowane,
- alkohol,
- mocna kawa i herbata,
- produkty mleczne z laktozą,
- pieczywo pełnoziarniste,
- nasiona roślin strączkowych,
- kasze,
- surowe warzywa.
W diecie powinny pojawić się potrawy lekkostrawne: chude mięso drobiowe, gotowane warzywa, kleiki ryżowe, ziemniaki, makaron.
Posiłki należy spożywać regularnie – 5-6 x dziennie, w małych porcjach, dokładnie przeżuwając pokarm. Dietę trzeba uzupełniać odpowiednią objętością płynów (minimum 2 litry dziennie). Probiotyki należy stosować pod kontrolą lekarza.
>> Sprawdź też: Leniwe jelita – jak poprawić perystaltykę jelit?
Jak uniknąć zakażenia Clostridioides difficile? Wskazówki dotyczące profilaktyki
Profilaktyka zakażeń C.difficile obejmuje:
- unikanie niepotrzebnego przyjmowania antybiotyków,
- dbanie o higienę rąk (częste i dokładne mycie mydłem),
- izolację osób chorych,
- unikanie w warunkach domowych wspólnego używania przedmiotów osobistych (np. gąbki, ręczniki),
- utrzymywanie reżimu sanitarnego w otoczeniu chorego.
Clostridioides difficile – sekcja FAQ
Z diety powinny być wykluczone potrawy niekorzystnie wpływających na perystaltykę jelit. Są to: potrawy smażone, tłuste, ostro przyprawione, pieczywo pełnoziarniste, kasze, mocna kawa i herbata, napoje gazowane, alkohol, produkty zawierające laktozę, surowe warzywa, nasiona roślin strączkowych.
Stolec jest płynny lub półpłynny, z reguły nie zawiera krwi i śluzu. Przy ciężkich zakażeniach śluz jest obecny.
CRP jest markerem stanu zapalnego. W przypadku zakażeń C.difficile poziom CRP jest podwyższony, a jego wartość ma związek z ciężkością zakażenia. Pacjenci z ciężkim przebiegiem choroby mają statystycznie wyższe stężenie CRP niż pacjenci z łagodną postacią choroby.
Standardowe leczenie trwa 10-14 dni.
Nie, infekcja C.difficile wiąże się ze stanem zapalnym jelit, sepsa to stan zagrażający życiu, który spowodowany jest niewłaściwą (rozregulowaną) reakcją ustroju na zakażenie.
Piśmiennictwo
- Prof. dr hab. med. Gajane Martirosian i inni „Zakażenia Clostridioides (Clostridium) difficile:epidemiologia, diagnostyka,terapia, profilaktyka” 2018 Rekomendacje Narodowego Programu Ochrony Antybiotyków na lata 2016-2020”.
- Prof. dr hab. med. Witold Bartnik „Zakażenie Clostridioides difficile” https://www.mp.pl/pacjent/gastrologia/choroby/jelitogrube/80812,zakazenie-clostridium-difficile (dostęp 19.10.2025 r.).
- M. Jagielski, Etiologia, obraz kliniczny i diagnostyka ostrych zakażeń i zarażeń przewodu pokarmowego oraz zatruć pokarmowych; Biblioteka Diagnosty Laboratoryjnego; Fundacja Pro Futura; Warszawa 2010.
- „Etiologia, obraz kliniczny i diagnostyka zakażeń przewodu pokarmowego i zatruć pokarmowych – wykłady”; Kurs dla diagnostów laboratoryjnych 28-30 maja 2014 r.; Kierownik naukowy kursu dr n.med. Jolanta Szych.