Ból mięśni, zmęczenie, ciemne zabarwienie moczu – to objawy, które mogą wskazywać na rabdomiolizę, czyli rozpad mięśni szkieletowych. Stan, który może prowadzić do poważnych powikłań nerkowych i zaburzeń elektrolitowych. Dowiedz się, co może wywołać rozpad mięśni i kiedy konieczna jest szybka interwencja medyczna.
| Z tego artykułu dowiesz się, że: >> rabdomioliza to stan spowodowany rozpadem mięśni szkieletowych, który może prowadzić do uszkodzenia nerek, >> jej przyczyną może być m.in. intensywny wysiłek fizyczny, uraz, infekcja lub działanie toksyn, >> objawy obejmują m.in. ból mięśni, osłabienie i ciemne zabarwienie moczu, >> podstawą rozpoznania są badania laboratoryjne (CK, kreatynina, mioglobina), >> szybkie nawodnienie i leczenie pozwalają uniknąć powikłań, >> rabdomiolizie można skutecznie zapobiegać – zwłaszcza u osób aktywnych fizycznie lub przyjmujących leki obciążające mięśnie. |
Spis treści:
- Co to jest rabdomioliza (rozpad mięśni)?
- Przyczyny rabdomiolizy
- Objawy rabdomiolizy – jak rozpoznać rozpad mięśni?
- Diagnostyka rabdomiolizy – jakie badania wykonać?
- Leczenie rabdomiolizy
- Jak zapobiegać rabdomiolizie?
- Rabdomioliza – odpowiedzi na najczęstsze pytania (FAQ)
Co to jest rabdomioliza (rozpad mięśni)?
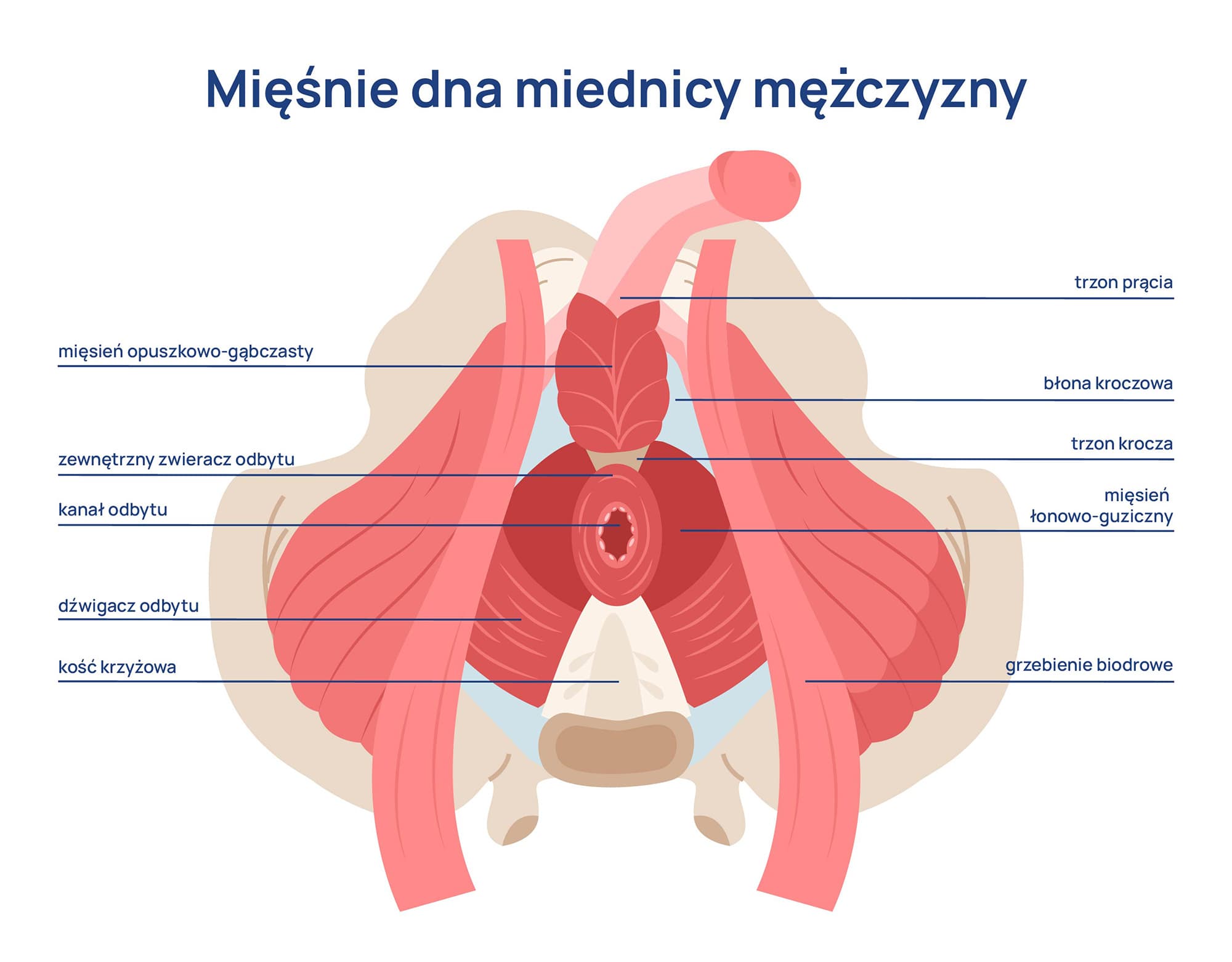
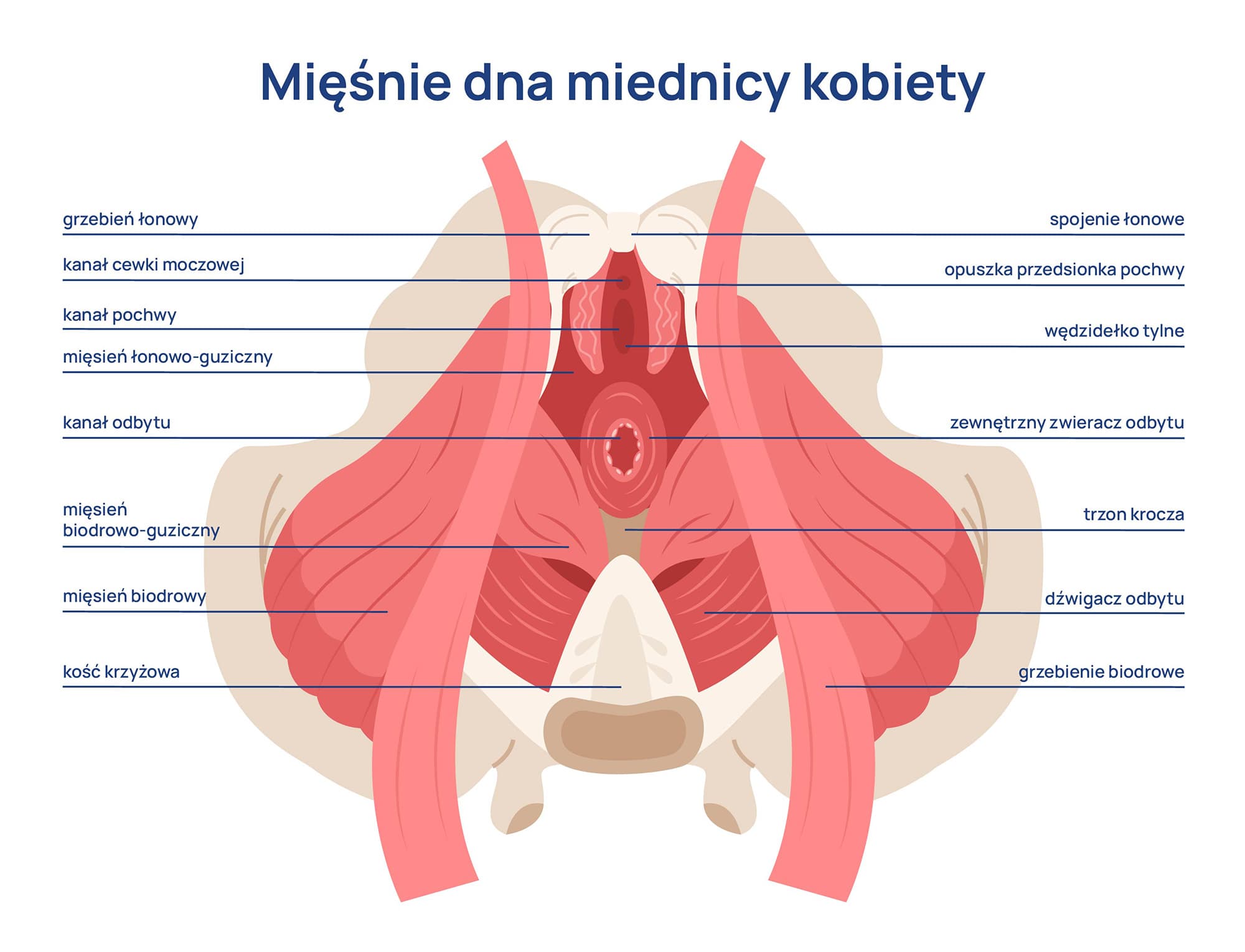
Rabdomioliza to zespół objawów wywołanych uszkodzeniem komórek mięśni szkieletowych, w wyniku którego ich składniki przedostają się do krwiobiegu. Mioglobina, enzymy i inne produkty rozpadu mogą obciążać nerki oraz prowadzić do zaburzeń metabolicznych i elektrolitowych. Ich obecność we krwi stanowi zagrożenie dla prawidłowego funkcjonowania całego organizmu, a w szczególności układu moczowego. W zależności od nasilenia, rabdomioliza może mieć łagodny przebieg lub skutkować poważnymi powikłaniami, takimi jak ostra niewydolność nerek.

Przyczyny rabdomiolizy
Rabdomioliza może być skutkiem wielu czynników – od urazów mechanicznych, przez intensywny wysiłek fizyczny w niekorzystnych warunkach, aż po zaburzenia metaboliczne, infekcje i działanie toksyn. Różnorodność przyczyn sprawia, że stan ten może wystąpić zarówno u sportowców, jak i u osób unieruchomionych czy przyjmujących niektóre leki.
Najczęstsze przyczyny wysiłkowe:
- intensywny trening bez odpowiedniej adaptacji,
- ćwiczenia w wysokiej temperaturze (ryzyko udaru cieplnego),
- odwodnienie podczas wysiłku,
- ekscentryczny skurcz mięśni (czyli taki, w którym mięsień się napina, ale jednocześnie wydłuża – np. podczas zjazdu na nartach, ćwiczeń typu CrossFit czy spinningu).
Inne przyczyny niewysiłkowe:
- długotrwałe unieruchomienie (np. po upadku),
- zespół zmiażdżenia, porażenie prądem,
- drgawki, stany pobudzenia psychoruchowego,
- infekcje wirusowe (np. grypa, HIV),
- stosowanie leków (statyny, kokaina, amfetaminy, neuroleptyki),
- zatrucia (alkohol, metale ciężkie),
- miopatie metaboliczne i dystrofie mięśniowe.
U niektórych osób rabdomioliza może być pierwszym objawem niewykrytej wcześniej choroby mięśni, np. miopatii metabolicznej – czyli zaburzenia przemian energetycznych w komórkach mięśniowych.
>> Przeczytaj również: Miastenia – choroba zmęczonych mięśni
Objawy rabdomiolizy – jak rozpoznać rozpad mięśni?
Obraz kliniczny rabdomiolizy zależy od przyczyny, nasilenia uszkodzenia mięśni i ogólnego stanu pacjenta.
Do typowych objawów należą:
- ból mięśni, najczęściej w obrębie ud, łydek, ramion lub pleców,
- osłabienie, sztywność lub uczucie napięcia mięśni,
- obrzęk kończyn,
- gorączka, przyspieszone tętno, nudności (w cięższych przypadkach),
- ciemne zabarwienie moczu – objaw charakterystyczny, spowodowany obecnością mioglobiny (mioglobinuria).
W badaniach laboratoryjnych obserwuje się:
- znaczny wzrost aktywności kinazy kreatynowej (CK),
- zaburzenia elektrolitowe: hiperkaliemię, hipofosfatemię, hipokalcemię,
- podwyższony poziom kreatyniny oraz objawy niewydolności nerek,
- wzrost aktywności AST i ALT – enzymów występujących także w mięśniach.

Diagnostyka rabdomiolizy – jakie badania wykonać?
Rozpoznanie rabdomiolizy opiera się na analizie objawów klinicznych i wynikach badań laboratoryjnych, które oceniają stopień uszkodzenia mięśni oraz ryzyko powikłań.
Kluczowe badania laboratoryjne:
- kinaza kreatynowa (CK) – podstawowy marker rozpadu mięśni; jej wysokie stężenie potwierdza uszkodzenie mięśni szkieletowych,
- badanie ogólne moczu – obecność mioglobiny przy braku erytrocytów wskazuje na rabdomiolizę,
- kreatynina i eGFR – ocena funkcji nerek i wykrycie wczesnych zaburzeń wydalania,
- elektrolity (K⁺, Ca²⁺, P) – nieprawidłowe wartości mogą powodować zaburzenia rytmu serca i inne powikłania,
- AST i ALT – enzymy wątrobowe, które wzrastają również przy uszkodzeniu mięśni.
W przypadku nietypowego przebiegu lub nawracających epizodów warto rozważyć dalszą diagnostykę w kierunku chorób mięśni (np. badania genetyczne, elektromiografia lub biopsja mięśnia – po ustąpieniu ostrej fazy).
>> Zobacz również: Mioglobina – co to jest i jaką pełni funkcję, na czym polega badanie i kiedy się je wykonuje?
Leczenie rabdomiolizy
Leczenie rabdomiolizy zależy od nasilenia objawów i ryzyka powikłań nerkowych. Kluczowe jest jak najszybsze wdrożenie odpowiedniej terapii, która ograniczy skutki rozpadu mięśni i zapobiegnie uszkodzeniu nerek.
Leczenie obejmuje:
- intensywne nawodnienie dożylne – celem osiągnięcia diurezy >200–300 ml/h,
- monitorowanie elektrolitów i ich wyrównywanie (szczególnie potasu, wapnia, fosforu),
- w cięższych przypadkach hospitalizacja, a czasem nawet dializoterapia,
- odstawienie leków potencjalnie toksycznych dla mięśni.
Nie zaleca się już rutynowego stosowania wodorowęglanów ani mannitolu.
| Ważne! Zgłoś się niezwłocznie do lekarza lub na SOR, jeśli po intensywnym wysiłku pojawi się silny ból mięśni, obrzęk, osłabienie lub ciemne zabarwienie moczu. Objawy te mogą świadczyć o rozwijającej się rabdomiolizie i wymagają pilnej diagnostyki oraz leczenia. |
Jak zapobiegać rabdomiolizie?
Ryzyko rabdomiolizy można ograniczyć, stosując się do kilku prostych zasad – szczególnie jeśli planujesz intensywny wysiłek fizyczny lub przyjmujesz leki obciążające mięśnie.
- Unikaj nadmiernego wysiłku fizycznego bez wcześniejszego przygotowania. Zwiększaj intensywność treningów stopniowo, zwłaszcza po przerwie.
- Zadbaj o odpowiednie nawodnienie, szczególnie w trakcie długotrwałego wysiłku lub treningu w wysokiej temperaturze.
- Nie ćwicz w upale ani w ubraniu ograniczającym chłodzenie organizmu.
- Zachowaj ostrożność przy stosowaniu leków takich jak statyny czy NLPZ. Ryzyko działań niepożądanych rośnie przy odwodnieniu lub interakcji z innymi lekami.
- Po epizodzie rabdomiolizy wstrzymaj się od intensywnych ćwiczeń na minimum 4 tygodnie. Powrót do aktywności powinien być kontrolowany i stopniowy.
Osoby z chorobami mięśni, zaburzeniami metabolicznymi lub przewlekłą chorobą nerek powinny zachować szczególną ostrożność i skonsultować się z lekarzem przed podjęciem intensywnego treningu.
Rabdomioliza – odpowiedzi na najczęstsze pytania (FAQ)
Tak, u większości pacjentów z łagodnym lub umiarkowanym przebiegiem objawy ustępują całkowicie po leczeniu. Kluczowe znaczenie ma szybkie rozpoznanie i odpowiednie nawodnienie, które chroni nerki przed uszkodzeniem.
Do leków najczęściej związanych z rabdomiolizą należą statyny, neuroleptyki, leki przeciwwirusowe (np. zydowudyna), amfetaminy, kokaina, lit i cyklosporyna. Ryzyko wzrasta m.in. przy odwodnieniu, intensywnym wysiłku fizycznym lub interakcjach z innymi substancjami.
Niektóre choroby mięśni, takie jak miopatie metaboliczne czy dystrofie mięśniowe, mogą prowadzić do rabdomiolizy – zwłaszcza po wysiłku, w czasie infekcji lub przy niedożywieniu. Dochodzi wtedy do rozpadu włókien mięśniowych i ich uszkodzenia.
Nie. Ciemne zabarwienie moczu w rabdomiolizie wynika z obecności mioglobiny (mioglobinurii), a nie krwi. Badanie ogólne moczu pozwala to odróżnić – nie stwierdza się obecności erytrocytów.
Bibliografia
- Bhai S., Dimachkie M.M. „Rhabdomyolysis: Clinical manifestations and diagnosis.” UpToDate, 2024.
- Fernandes P.M., Davenport R.J. „How to do it: investigate exertional rhabdomyolysis (or not).” Practical Neurology, 2019; 19:43–48.
- Olszewski J. „Rabdomioliza.”, Twój Dyżur (dostęp 5 listopada 2025). https://twojdyzur.pl/rabdomioliza