Zimne dłonie, mrowienie w stopach czy przewlekłe zmęczenie często tłumaczy się stresem lub przemęczeniem, tymczasem mogą one wskazywać na zaburzenia, które wpływają na funkcjonowanie całego organizmu. Sprawny przepływ krwi jest fundamentem zdrowia – to dzięki niemu każda komórka otrzymuje tlen i niezbędne składniki odżywcze. Gdy dochodzi do zaburzeń tego mechanizmu, pojawiają się objawy, których nie warto ignorować. Warto więc zrozumieć, skąd bierze się tak zwane „słabe krążenie” i dlaczego jego wczesne wykrycie jest tak ważne dla naszego zdrowia.
| Z tego artykułu dowiesz się: >> czym jest słabe krążenie; >> jakie są przyczyny słabego krążenia; >> czym objawia się słabe krążenie; >> jak radzić sobie ze słabym krążeniem; >> jakie badania wykonać w przypadku słabego krążenia. |
Spis treści:
- Czym jest słabe krążenie?
- Słabe krążenie: objawy
- Słabe krążenie w nogach, rękach i nie tylko: przyczyny dolegliwości
- Słabe krążenie krwi: jakie badania?
- Jak poprawić słabe krążenie krwi?
- Słabe krążenie: najczęstsze pytania (FAQ)
- Słabe krążenie: podsumowanie
Czym jest słabe krążenie?
Słabe krążenie to zaburzenie, w którym krew nie przepływa w sposób prawidłowy przez sieć naczyń krwionośnych – tętnice, żyły i naczynia włosowate.
Pojęcie „słabe krążenie” to potoczne określenie stanu, w którym przepływ krwi przez sieć naczyń krwionośnych – tętnic, żył i naczyń włosowatych – jest nieprawidłowy lub niewystarczający. W jego wyniku tkanki organizmu nie otrzymują wystarczającej ilości tlenu i substancji odżywczych, co może prowadzić do wielu objawów i rozwoju zaawansowanych schorzeń. Najczęściej problem dotyczy kończyn – zimne dłonie i stopy, drętwienie czy uczucie ciężkości nóg to jedne z pierwszych sygnałów ostrzegawczych.
Warto zaznaczyć, że „słabe krążenie” nie jest terminem medycznym ani samodzielną jednostką chorobową ujętą w klasyfikacji ICD-10. Określenie to związane jest z różnymi zaburzeniami w funkcjonowaniu układu naczyniowego, takimi jak miażdżyca, niewydolność serca, przewlekła niewydolność żylna czy angiopatie cukrzycowe.
>> Przeczytaj: Niskie ciśnienie: objawy, przyczyny. Czym grozi i kiedy wymaga leczenia?

Słabe krążenie: objawy
Objawy słabego krążenia potrafią rozwijać się stopniowo, często niepostrzeżenie, by z czasem stać się coraz bardziej dokuczliwe. To, co początkowo wydaje się błahym dyskomfortem, może być sygnałem poważnych zaburzeń w pracy układu sercowo-naczyniowego. Warto zatem wsłuchać się w sygnały wysyłane przez organizm i zwracać uwagę na niepokojące zmiany. Najczęstsze symptomy słabego krążenia obejmują:
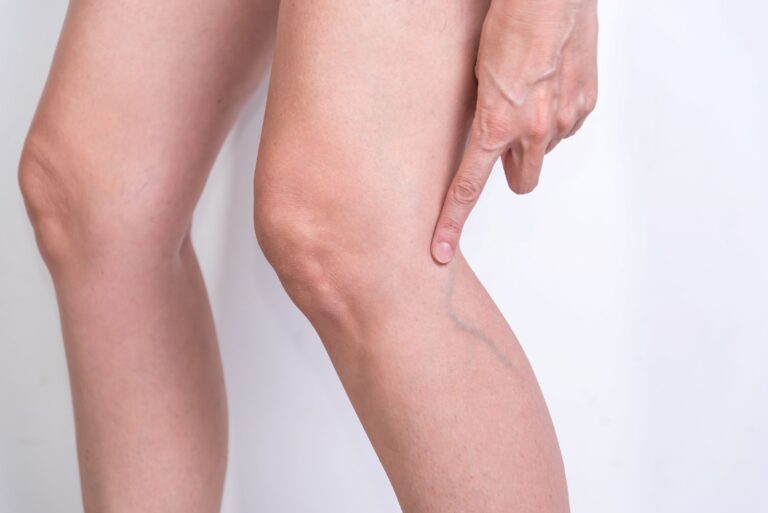
- zimne dłonie i stopy – uczucie chłodu w kończynach, nawet w ciepłym otoczeniu, często wynikają z niedokrwienia obwodowego, typowego dla zaburzeń krążenia tętniczego. Skóra może być blada, chłodna, a w przypadku znacznego niedotlenienia – z sinawym odcieniem;
- mrowienie i drętwienie – charakterystyczne „igiełki” lub utrata czucia, szczególnie po dłuższym siedzeniu, świadczą o tym, że krew nie dociera do tkanek w wystarczającym stopniu;
- obrzęki nóg i rąk – najczęściej spowodowane przewlekłą niewydolnością żylną lub niewydolnością serca – zastój krwi powoduje gromadzenie się płynów w tkankach, co prowadzi do opuchlizny, nasilającej się zwłaszcza pod koniec dnia;
- zmęczenie i osłabienie nóg – brak odpowiedniego dotlenienia mięśni sprawia, że nawet krótki spacer może wywoływać uczucie ciężkości i znużenia;
- ból i skurcze mięśni – szczególnie w łydkach, często nasilające się w nocy lub podczas chodzenia. Tzw. chromanie przestankowe może być oznaką zwężenia tętnic spowodowanego miażdżycą;
- zmiany skórne – sucha, łuszcząca się lub przebarwiona skóra, a w zaawansowanych przypadkach – trudno gojące się rany i owrzodzenia;
- problemy z koncentracją i pamięcią – przewlekłe zaburzenia krążenia mózgowego mogą prowadzić do uczucia dezorientacji, pogorszenia uwagi i osłabienia zdolności poznawczych;
- wolniejsze gojenie ran – niedokrwienie ogranicza dopływ tlenu i składników odżywczych do uszkodzonych tkanek, co wydłuża czas ich regeneracji, szczególnie u osób z cukrzycą lub miażdżycą.
Objawy te mogą występować pojedynczo lub w różnych kombinacjach, w zależności od przyczyny zaburzeń krążenia i ich zaawansowania. Wczesna reakcja – konsultacja z lekarzem, zmiana stylu życia czy diagnostyka układu krążenia – może zapobiec poważnym powikłaniom, takim jak zawał serca czy udar mózgu.
>> Sprawdź też: Najczęstsze choroby serca – objawy i diagnostyka
Słabe krążenie w nogach, rękach i nie tylko: przyczyny dolegliwości
Aby skutecznie przeciwdziałać słabemu krążeniu, należy zrozumieć, skąd ono się bierze. Układ sercowo-naczyniowy to złożony system, w którym nawet niewielkie zaburzenia mogą zaburzyć przepływ krwi i dotlenienie tkanek.
Przyczyny problemów z krążeniem są różnorodne – od chorób przewlekłych po czynniki związane ze stylem życia. Wiele z nich wzajemnie się nakłada, potęgując ryzyko wystąpienia dolegliwości. Do najczęstszych należą:
- miażdżyca – odkładanie się blaszek cholesterolowych w ścianach tętnic zwęża ich światło, utrudniając swobodny przepływ krwi i zmniejszając dopływ tlenu do narządów;
- zakrzepica żył głębokich – powstawanie skrzepów blokuje naczynia, zwykle kończyn dolnych, prowadząc do obrzęków, bólu i poważnych powikłań, takich jak zatorowość płucna;
- cukrzyca – uszkadza drobne naczynia krwionośne (angiopatia cukrzycowa) i nerwy, co powoduje pogorszenie ukrwienia kończyn, zwłaszcza stóp;
- nadciśnienie tętnicze – stale zwiększone ciśnienie uszkadza ściany naczyń, prowadząc do utraty ich elastyczności i zwężenia;
- przewlekła niewydolność żylna – spowodowana uszkodzeniem zastawek w żyłach nóg, skutkuje zastojem krwi, obrzękami i uczuciem ciężkości kończyn;
- siedzący lub stojący tryb życia – ograniczony ruch spowalnia pracę „pompy mięśniowej” i utrudnia powrót krwi do serca;
- palenie papierosów – nikotyna obkurcza naczynia, zwiększa lepkość krwi i obniża jej zdolność do transportu tlenu;
- otyłość i niezdrowa dieta – sprzyjają wzrostowi poziomu cholesterolu i glukozy we krwi, co przyspiesza rozwój zmian miażdżycowych;
- choroby serca i nerek – niewydolność tych narządów prowadzi do zaburzeń w regulacji ciśnienia tętniczego oraz objętości krwi krążącej, co może prowadzić do obrzęków i spadku perfuzji tkanek.
>> Zobacz: Przewlekła choroba nerek – objawy, przyczyny, powikłania, diagnostyka
Słabe krążenie krwi: jakie badania?
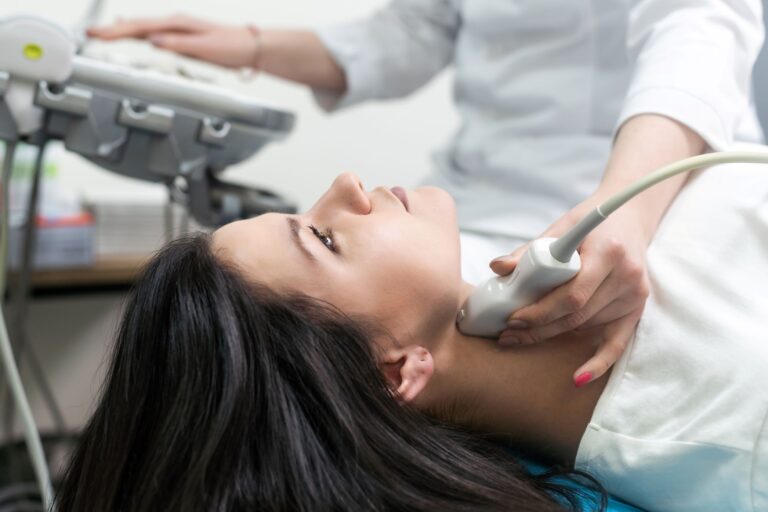
Podstawą diagnostyki słabego krążenia są badania krwi, które stanowią nieocenione źródło informacji o kondycji układu sercowo-naczyniowego i procesach zachodzących w organizmie. To właśnie z ich pomocą lekarz może wstępnie określić, czy problemy z krążeniem wynikają z miażdżycy, cukrzycy, zaburzeń lipidowych, czy też innych schorzeń wpływających na naczynia. Badania laboratoryjne pozwalają wykryć zagrożenia, zanim jeszcze pojawią się wyraźne objawy kliniczne.
W diagnostyce szczególne znaczenie mają:
- morfologia krwi – podstawowe badanie oceniające liczbę czerwonych krwinek, stężenie hemoglobiny i inne parametry, które pomagają ocenić, czy występuje niedokrwistość mogąca wpływać na dotlenienie tkanek;
- lipidogram – określa poziom cholesterolu całkowitego, frakcji LDL i HDL oraz trójglicerydów. Wysokie stężenie „złego” cholesterolu (LDL) sprzyja odkładaniu się blaszek miażdżycowych, które zwężają naczynia krwionośne;
- poziom glukozy i hemoglobiny glikowanej (HbA1c) – badania pozwalające ocenić, czy w organizmie nie rozwija się cukrzyca lub insulinooporność, prowadzące do mikrouszkodzeń naczyń;
- stężenie homocysteiny – podwyższony poziom tego aminokwasu jest czynnikiem ryzyka miażdżycy i zakrzepicy, nawet przy prawidłowym profilu lipidowym;
- lipoproteina(a) – marker genetycznej predyspozycji do zaburzeń lipidowych i miażdżycy, szczególnie przydatny w przypadku rodzinnego występowania chorób serca.
Choć badania krwi stanowią pierwszy i najważniejszy etap diagnostyki, lekarz często uzupełnia je o pomiar ciśnienia tętniczego, wskaźnik kostkowo-ramienny (ABI) czy USG Doppler, które pozwalają ocenić przepływ krwi w tętnicach i żyłach. W razie potrzeby wykonuje się też bardziej zaawansowane badania, takie jak EKG, echo serca, czy angiografia.

Jak poprawić słabe krążenie krwi?
Sprawny przepływ krwi warunkuje dotlenienie wszystkich narządów, wpływa na wydolność fizyczną, koncentrację i regenerację tkanek. Choć przyczyny osłabionego krążenia bywają różne, w większości przypadków można znacząco poprawić jego efektywność poprzez zmianę stylu życia, odpowiednią dietę i właściwą profilaktykę, a mianowicie:
- Zadbaj o regularną aktywność fizyczną – ruch jest naturalnym „pompowaniem” krwi. Codzienne spacery, lekkie ćwiczenia aerobowe, pływanie czy jazda na rowerze przez 20-30 minut dziennie wystarczą, by pobudzić krążenie i wzmocnić serce. W pracy lub w podróży warto co pewien czas poruszać stopami lub wspinać się naprzemiennie na palce i pięty.
- Stosuj zbilansowaną dietę – menu powinno być bogate w warzywa, produkty pełnoziarniste, rośliny strączkowe oraz orzechy. Należy ograniczyć sól, tłuszcze nasycone i cukry proste, które sprzyjają rozwojowi miażdżycy. Warto również pamiętać o regularnym spożywaniu posiłków i unikaniu przejadania się.
- Utrzymuj odpowiednie nawodnienie – krew w 80% składa się z wody, dlatego jej odpowiednia lepkość zależy od codziennego nawadniania. Wypijaj minimum 1,5-2 litry wody dziennie, aby ułatwić sercu pompowanie krwi i zapobiec jej zagęszczaniu.
- Zrezygnuj z palenia i ogranicz alkohol – nikotyna obkurcza naczynia krwionośne, a alkohol w nadmiarze uszkadza ich ściany. Rzucenie palenia to jeden z najskuteczniejszych sposobów poprawy mikrokrążenia i ochrony serca.
- Zadbaj o odpoczynek i ułożenie nóg – po dniu spędzonym w pozycji stojącej lub siedzącej unieś nogi lekko ponad poziom serca, np. podkładając pod nie poduszkę. Takie działania są szczególnie istotne w przypadku przewlekłej niewydolności żylnej – ułatwiają odpływ krwi z kończyn i zmniejszają obrzęki.
- Wypróbuj kompresjoterapię – specjalistyczne pończochy, podkolanówki lub rajstopy uciskowe wspierają krążenie, przeciwdziałają zastojom krwi i obrzękom. Siłę ucisku zawsze należy dobrać po konsultacji ze specjalistą.
- Unikaj wychłodzenia kończyn – niska temperatura powoduje dodatkowe obkurczenie naczyń.
W przypadkach bardziej zaawansowanych lekarz może zalecić farmakoterapię – leki poprawiające elastyczność naczyń, obniżające poziom cholesterolu lub rozrzedzające krew.

Słabe krążenie: najczęstsze pytania (FAQ)
Nogi ze słabym krążeniem często są zimne, blade lub sine. Mogą występować obrzęki, uczucie ciężkości, drętwienie oraz sucha, łuszcząca się skóra. W bardziej zaawansowanych przypadkach pojawiają się pajączki naczyniowe, żylaki czy trudno gojące się rany.
Dla poprawy krążenia warto pić wodę (co najmniej 1,5-2 litry dziennie), a także zieloną herbatę, napary z imbiru, głogu, miłorzębu japońskiego czy sok z buraka. Mają one charakter wspierający, ale nie zastąpią diagnostyki i leczenia przyczynowego zaburzeń układu krążenia.
Na prawidłowe krążenie szczególnie korzystnie wpływają witaminy C, E, B3 (niacyna) oraz rutyna i flawonoidy, które wzmacniają naczynia krwionośne, poprawiają elastyczność ich ścian i wspierają mikrokrążenie.
Słabe krążenie: podsumowanie
Podsumowując, słabe krążenie to sygnał, którego nie należy lekceważyć – pozornie błahe objawy mogą wskazywać na zaburzenia w funkcjonowaniu układu naczyniowego lub serca. Świadomość własnego ciała, obserwacja nawet subtelnych sygnałów, jakie wysyła organizm i regularne badania pozwalają wcześnie wykryć nieprawidłowości i w porę podjąć działania profilaktyczne.
Jeśli zauważysz u siebie objawy mogące świadczyć o problemach z krążeniem, nie zwlekaj z diagnostyką. Wykonanie podstawowych badań laboratoryjnych może pomóc w wykryciu zaburzeń na wczesnym etapie.
Opieka merytoryczna: lek. Maria Wydra
Bibliografia
- Korczyk R., Problemy z krążeniem – jakie są objawy i przyczyny słabego krążenia?, wylecz.to, 2022.
- Martinez-Zapata MJ, Vernooij RWM, Simancas-Racines D, Uriona Tuma SM, Stein AT, Moreno Carriles RMM, Vargas E, Bonfill Cosp X. Phlebotonics for venous insufficiency. Cochrane Database of Systematic Reviews 2020.
- Marti C. N., Georgiopoulou V. V., Kalogeropoulos A. P., Acute heart failure: patient characteristics and pathophysiology. Curr. Heart Fail. Rep., 2013, 10: 427–433.
- Boisseau M.R. i inni, Fibrinolysis and hemorheology in chronic venous insufficiency, a double blind study of troxerutin efficiency. J. Cardiovasc. Surg. 1995, 36, 369.