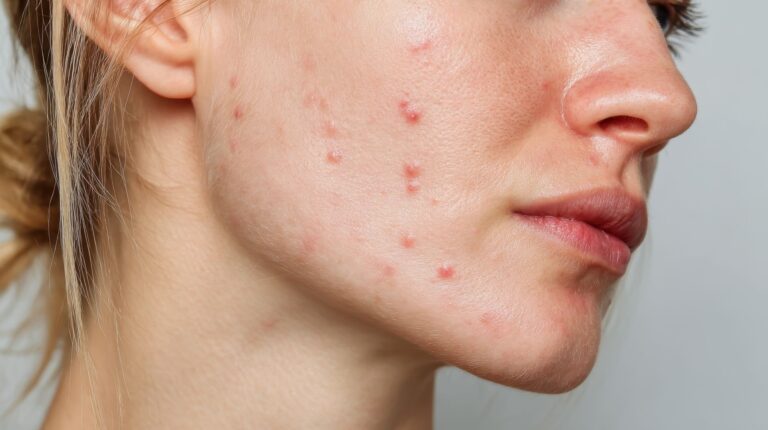
Śmiało można powiedzieć, że trądzik pospolity to najczęstsze schorzenie dermatologiczne, zaliczane do chorób przewlekłych. Szacuje się, że problem trądziku dotyczy nawet 80–100% pacjentów pomiędzy 11. a 30. rokiem życia.
Z tego artykułu dowiesz się:
- Jaki jest związek pomiędzy pojawianiem się zmian trądzikowych a androgenami?
- Jak objawia się trądzik androgenny?
- Kiedy warto wykonać badania w kierunku zaburzeń hormonalnych?
- Jak leczyć trądzik pospolity, któremu towarzyszą zaburzenia hormonalne?
Spis treści:
- Czym jest trądzik androgenny?
- Trądzik estrogenny a androgenny – różnice
- Przyczyny trądziku androgennego
- Trądzik androgenny – objawy
- Trądzik androgenny – jakie badania wykonać?
- Leczenie trądziku androgennego
- Metody wspierające leczenie trądziku androgennego
Czym jest trądzik androgenny?
Należy wyraźnie podkreślić, że trądzik androgenny to określenie potoczne, które nie jest nieużywane w profesjonalnej terminologii dermatologicznej. W artykule tym podejmowane będą tematy związane z zaburzeniami hormonalnymi, które mogą w niektórych przypadkach wpisywać się w złożoną etiopatogenezę trądziku pospolitego. Dla uproszczenia i lepszego zrozumienia tematu, zaburzenia te będą określane mianem trądziku androgennego.
Trądzik pospolity (oznaczany w klasyfikacji ICD-10 kodem L70.0) może być elementem obrazu klinicznego wielu zaburzeń hormonalnych, o czym więcej można przeczytać w kolejnych akapitach tego artykułu.
>> Przeczytaj także: Trądzik – choroba o wielu obliczach
Trądzik estrogenny a androgenny – różnice
Sformułowania te nie są powszechnie stosowane w dermatologii, choć wahania stężeń androgenów i estrogenów mogą mieć istotny wpływ na pojawianie się zmian trądzikowych. W przypadku trądziku pospolitego, objawy mogą wynikać nie tylko ze wspomnianego już wzrostu stężenia androgenów (potocznie trądzik androgenny), ale również z niedoboru estrogenów, co automatycznie powoduje stosunkowy nadmiar androgenów. Tego rodzaju sytuację określa się niekiedy jako trądzik estrogenny, choć nie jest to naukowe określenie na tego rodzaju zaburzenia.
Przyczyny trądziku androgennego
Zmiany trądzikowe o podłożu androgenowym są najczęściej składową obrazu klinicznego zespołu policystycznych jajników (PCOS).
Hiperandrogenizm towarzyszy również takim schorzeniom i stanom klinicznym jak:
- guzy jajnika i nadnerczy produkujące androgeny – przykładem są guzy z komórek Sertoliego i Leydiga,
- nadczynność tarczycy,
- akromegalia – której istotą jest wzrost stężenia hormonu wzrostu,
- wrodzony przerost nadnerczy – przyczyną tego schorzenia jest najczęściej niedobór 21-hydroksylazy, prowadzący do wzrostu stężenia hormonu adrenokortykotropowego i tym samym przerostu nadnerczy, czego konsekwencją jest zwiększona produkcja androgenów,
- zespół Cushinga – wynikający z nadmiaru hormonu stresu, a więc kortyzolu,
- przyjmowanie leków o działaniu androgenowym – w tym sterydów, czy danazolu,
- insulinooporność,
- otyłość.
W jaki sposób wzrost stężenia androgenów prowadzi do pojawienia się zmian trądzikowych? Hiperandrogenizm sprzyja bowiem takim nieprawidłowościom jak:
- wzrost aktywności gruczołów łojowych i nadprodukcja sebum – jest to świetnym podłożem do namnażania się bakterii Propionibacterium acnes (Cutibacterium acnes),
- zwiększona proliferacja keratynocytów (komórek naskórka) – prowadząca do zaczopowania ujść mieszków włosowych i pojawiania się zmian zaskórnikowych,
- nasilenie stanu zapalnego w obrębie skóry.
>> Dowiedz się więcej: Trądzik dorosłych
Trądzik androgenny – objawy
Zmiany skórne, które obserwuje się w zaburzeniach hormonalnych nie różnią się istotnie od wykwitów chorobowych w klasycznej postaci trądziku pospolitego. Obserwuje się przede wszystkim obecność:
- zaskórników zamkniętych – są to niewielkie grudki w kolorze skóry, ich istotą jest nagromadzenie się łoju i keratyny w rozdętym mieszku włosowym,
- zaskórników otwartych – są to niewielkie, czarne grudki, które powstają na skutek nagromadzenia melaniny i utlenienia lipidów,
- zapalnych grudek – zmian wyniosłych ponad poziom skóry, rumieniowych,
- krost – zmian wyniosłych ponad poziom skóry, wypełnionych treścią ropną,
- niekiedy torbieli, a nawet guzów – zmiany te związane z wysokim ryzykiem bliznowacenia.
Zmiany trądzikowe najczęściej lokalizują się na twarzy, jednak mogą być również obecne na plecach, na klatce piersiowej, pośladkach, a nawet na kończynach.
>> Dowiedz się więcej: Krosty na twarzy: rodzaje i możliwe przyczyny. Jak pozbyć się krost na twarzy?
Trądzik androgenny – jakie badania wykonać?
Należy wyraźnie podkreślić, że nie każdy trądzik wymaga wykonywania badań hormonalnych. Jednak pojawienie się pewnych dodatkowych objawów, powinno skłonić do konsultacji ginekologicznej lub endokrynologicznej i pogłębienia diagnostyki. Do symptomów, które mogą świadczyć o zaburzeniach hormonalnych, w tym hiperandrogenizmie zalicza się przede wszystkim:
- pojawienie się nadmiernego owłosienia – szczególnie na twarzy, brzuchu, klatce piersiowej, wokół brodawek sutkowych,
- przerzedzenie włosów – typowo o charakterze łysienia androgenowego,
- zaburzenia miesiączkowania – w tym nieregularne miesiączki, a nawet zupełny brak miesiączki,
- niepłodność,
- niekiedy nadwaga i otyłość,
- acanthosis nigricans – ciemnienie skóry w okolicy szyi i karku,
- zaburzenia nastroju, zaburzenia depresyjne,
- wzrost ciśnienia tętniczego,
- pojawienie się rozstępów,
- przy wysokim stężenie androgenów – zmiany dotyczące sylwetki, pogrubienie głosu.
Przy podejrzeniu hipeanrogenizmu konieczne jest przeprowadzenie wnikliwego wywiadu chorobowego i badania przedmiotowego pacjentki, w tym badania całej skóry i przydatków. Niezbędna jest również konsultacja ginekologiczna, wraz z dokładnym badaniem ginekologicznym i wykonaniem badania ultrasonograficznego (USG).
>> Przeczytaj również: Trądzik różowaty (acne rosacea)
Badania laboratoryjne i oznaczenia wykonywane w przypadku podejrzenia zaburzeń hormonalnych i zespołu policystycznych jajników to przede wszystkim:
- stężenie progesteronu w fazie lutealnej,
- ocena profilu androgenów – oznaczenie stężenia całkowitego testosteronu, wolnego testosteronu, androstendionu, 17-hydroksyprogesteronu, a także siarczanu dehydroepiandrosteronu (DHEAS),
- oznaczenie globuliny wiążącej hormony płciowe (SHBG – sex hormone binding globulin),
- oznaczenie panelu tarczycowego – stężenia TSH, fT3, fT4,
- stężenie prolaktyny – najlepiej w fazie folikularnej,
- stężenie wolnego kortyzolu w dobowej zbiórce moczu, a także test z deksametazonem – w celu wykluczenia zespołu Cushinga,
- stężenie hormonu wzrostu (somatotropiny) – w przypadku podejrzenia akromegalii.
Leczenie trądziku androgennego
Jeżeli zmiany trądzikowe towarzyszą zaburzeniom ginekologicznym i endokrynologicznym – konieczne jest leczenie choroby podstawowej. W terapii hiperandrogenizmu zastosowanie znajdują między innymi:
- dwuskładnikowe leczenie antykoncepcyjne – z zawartością progestagenu o działaniu antyandrogennym (na przykład drospirenon, czy octan cyproteronu),
- substancje antyandrogenne– w tym m. in. flutamid, spironolakton, czy też finasteryd,
- metformina – obniża stężenie androgenów, zwiększa wydzielania estrogenów, a co więcej, zwiększa produkcję SHBG.
Należy podkreślić, że leczenie endokrynologiczne powinno być poprzedzone wnikliwą diagnostyką hormonalną i ginekologiczną. Terapia dobierana jest indywidualnie przez lekarza prowadzącego.
W terapii dermatologicznej zmian trądzikowych stosuje się natomiast zarówno leczenie miejscowe, jak i ogólne. Substancje wykorzystywane w leczeniu trądziku to przede wszystkim:
- retinoidy miejscowe – na przykład adapalen, czy trifaroten, substancje te są dostępne w postaci żelu, ale również kremu,
- nadtlenek benzoilu – stosowany miejscowo, działa zarówno bakteriobójczo, keratolitycznie, jak i przeciwzapalnie,
- antybiotyki w postaci miejscowej – na przykład klindamycyna, czy erytromycyna, należy podkreślić, że antybiotyki nie powinny być stosowane w monoterapii (jako jedyny lek), ponieważ grozi to narastaniem oporności bakterii,
- kwas azelainowy w postaci miejscowej – hamuje namnażanie bakterii Propionibacterium acnes, a także zmniejsza łojotok i wykazuje działanie przeciwzapalne,
- antybiotyki w postaci ogólnej (tabletki, kapsułki) – na przykład tetracykliny, limecyklina, czy klindamycyna,
- doustna izotretynoina – jest to pochodna witaminy A, która działa między innymi poprzez zmniejszenia aktywności gruczołów łojowych, a także normalizację procesu keratynizacji w obrębie ujść mieszków włosowych, lek ten wymaga wykonywania regularnych badań kontrolnych i powinien być stosowany tylko pod opieką lekarza.
Metody wspierające leczenie trądziku androgennego
Należy zaznaczyć, że terapia trądziku pospolitego, również w przypadku zaburzeń hormonalnych, wymaga rozpoczęcia odpowiedniej pielęgnacji z wykorzystaniem dermokosmetyków. Warto wybierać delikatne preparaty myjące, które nie zaburzają bariery naskórkowej. Jeżeli stosowane są retinoidy miejscowe lub izotretynoina – konieczne jest intensywne postępowanie nawilżające i regenerujące, ponieważ substancje te mogą powodować wysuszenie skóry i jej podrażnienie. Warto wybierać produkty zawierające takie substancje aktywne jak ceramidy, kwas hialuronowy, czy pantenol. Konieczne jest również stosowanie kremów z filtrem, najlepiej SPF 50.
Dieta przy trądziku androgennym
W leczeniu zmian skórnych istotną rolę odgrywa postępowanie dietetyczne, lecz należy mieć świadomość, że powinno się unikać wykluczania konkretnych produktów. W badaniach naukowych nie powiązano bowiem pojawiania się zmian trądzikowych z konkretnym rodzajem pokarmu. Wiadomo jednak, że do zaostrzeń może predysponować spożywanie produktów wysokoprzetworzonych, a także o wysokim indeksie glikemicznym. W pojedynczych doniesieniach zauważono również związek pomiędzy nasileniem zmian trądzikowych, a spożywaniem nabiału. Wynika to najprawdopodobniej z dodawania preparatów hormonalnych do pasz zwierząt.
Zioła na trądzik androgenny
Preparaty ziołowe nie są uznanym medycznie sposobem na leczenie zmian trądzikowych. W celu podjęcia odpowiedniej terapii warto udać się na konsultację do lekarza dermatologa. W przypadku takiej konieczności, lekarz może zalecić wykonanie konsultacji ginekologicznej lub endokrynologicznej, w celu wykluczenia schorzeń związanych z hiperandrogenizmem.
Bibliografia
- J. Szepietowski, Trądzik zwyczajny: patogeneza i leczenie. Konsensus Polskiego Towarzystwa Dermatologicznego, Przegl Dermatol 2012, 99, 649–673,
- A. Milewicz, Stanowisko Polskiego Towarzystwa Endokrynologicznego, Polskiego Towarzystwa Ginekologów i Położników oraz Polskiego Towarzystwa Endokrynologii Ginekologicznej w sprawie diagnostyki i leczenia zespołu policystycznych jajników, Endokrynologia Polska Tom/Volume 69; Numer/Number 4/2018,
- R. V. Reynolds, Guidelines of care for the management of acne vulgaris, Acad Dermatol 2024;90:1006.e1-30.