Eozynofilia to stan, w którym stwierdza się za wysoki poziom eozynofili we krwi obwodowej. Czy eozynofilia to choroba, na czym polega diagnostyka eozynofilii, jakie mogą być jej przyczyny u dorosłych.
Spis treści:
- Co to jest eozynofilia – definicja
- Przyczyny eozynofilii
- Objawy eozynofilii u dorosłych
- Wysokie eozynofile – diagnostyka
- Eozynofila – najczęściej zadawane pytania (FAQ)
- Co to znaczy, że mam „podwyższone eozynofile” (eozynofilia)?
- Czy podwyższone eozynofile zawsze oznaczają coś poważnego?
- O czym świadczą podwyższone eozynofile reszta w normie?
- Czy eozynofilia może być dziedziczna?
- Do jakiego lekarza należy się zgłosić z podwyższonymi eozynofilami?
- O czym mogą świadczyć dwukrotnie podwyższone eozynofile?
Co to jest eozynofilia – definicja
Czym są eozynofile?
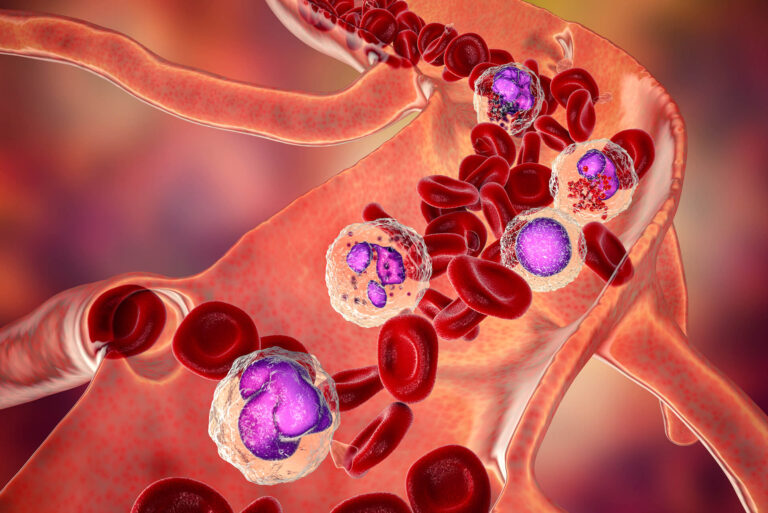
Eozynofile to rodzaj białych komórek krwi (leukocytów), określane również jako granulocyty obojętnochłonne. Ich główną funkcją jest obrona organizmu przed pasożytami, biorą również udział w odpowiedzi immunologicznej.
W szpiku kostnym dorosłego człowieka znajduje się ok. 3% eozynofilów.
Liczba eozynofili we krwi obwodowej, czyli eozynofilia bezwzględna, powinna wynosić 0,05-0,50×10^9/L. Badanie ich poziomu jest elementem morfologii krwi, a same komórki bywają też nazywane eozynocytami – eozynofile i eozynocyty są tymi samymi komórkami.
W morfologii znajdziemy również zawartość procentową poszczególnych rodzajów leukocytów, eozynocyty powinny stanowić od 0 do 5% białych ciałek krwi.

Eozynofile są komórkami, które krótko przebywają we krwi – ok. 36 godzin – po czym przemieszczają się do narządów i tkanek, gdzie mają kontakt ze środowiskiem zewnętrznym.
Eozynofilia – zbyt wysoka liczba eozynofili
Eozynofilia to stan, w którym liczba eozynofili jest podwyższona i wynosi > 0,50 x 10^9/L. Wyróżnia się:
- eozynofilię łagodną – stan, w którym eozynofile są nieznacznie podwyższone, ich liczba jest niższa niż 1,5 x 10^9/L.
- eozynofilię umiarkowaną – 1,5-5 x 10^9/L.
- eozynofilię ciężką – powyżej 5 x x 10^9/L.
Przyczyny eozynofilii
Eozynofila nie jest chorobą, jest objawem, którego przyczynę zawsze należy zdiagnozować.
Eozynofilia wtórna
Najczęstszą przyczyną podwyższonego poziomu eozynofili jest eozynofilia wtórna, czyli reaktywna, obserwowana w wielu schorzeniach.
- Infekcje pasożytnicze – eozynofile powyżej normy są bardzo często obserwowane w przebiegu zakażenia tasiemcem, węgorkiem jelitowym, bąblowcem, glistą ludzką, itp.
- Infekcje niepasożytnicze – podniesiony poziom eozynofili zdarza się w okresie zdrowienia po infekcji, w przebiegu aspergilozy, choroby kociego pazura, zakażenia grzybami Cryptococcus.
- Choroby alergiczne – w chorobach alergicznych częstotliwość występowania eozynofilii jest wysoka. Towarzyszy ona alergicznemu nieżytowi nosa, atopowemu zapaleniu skóry, pokrzywce, astmie oskrzelowej, obrzękowi naczynioruchowemu Quincke`go.
- Choroby idiopatyczne lub układowe – eozynofilowe zapalenie płuc, eozynofilowe zapalenie naczyń (z. Churg-Strauss), eozynofilowe zapalenie przełyku, żołądka, jelit.
- Choroby nowotworowe – w chorobie Hodgkina, niektórych guzach litych, w przerzutach nowotworowych eozynofilia występuje z umiarkowaną częstotliwością.
- Choroby tkanki łącznej – guzkowe zapalenie tętnic, choroba posurowicza, niektóre kolagenozy.
- Choroby autoimmunologiczne – niedobory IgA, reumatoidalne zapalenie stawów, zespół Wiskotta-Aldricha.
- Zaburzenia endokrynologiczne – choroba Addisona.
- Leki – eozynofilia związana z podawaniem leków spotykana jest stosunkowo rzadko, mogą ją wywoływać sulfonamidy, sole złota, analogi puryn, karbamazepina, czynnik wzrostu.
>> Przeczytaj też: Glistnica (askarioza) – choroba pasożytnicza układu pokarmowego
Eozynofilia pierwotna
Stan, który występuje w rozrostach nowotworowych, tzw. eozynofilia klonalna. Druga grupa schorzeń to eozynofilia idiopatyczna, którą rozpoznaje się po wykluczeniu eozynofilii wtórnej i klonalnej.
Eozynofilie klonalne związane są z występowaniem limfocytów T o nietypowym obrazie. Natomiast eozynofilia idiopatyczna przyjmuje postać zespołu hipereozynofilowego (HES), w którym obserwuje się stale zwiększoną liczbę eozynocytów przez okres powyżej 6 miesięcy.
Objawy eozynofilii u dorosłych
Charakter dolegliwości i objawów towarzyszących eozynofilii jest bezpośrednio związany z jej pierwotną przyczyną. Ponieważ podwyższony poziom granulocytów kwasochłonnych obserwuje się w wielu schorzeniach, symptomy wskazujące na ich zwiększoną liczbę mogą obejmować:
- objawy alergiczne: swędząca wysypka, katar sienny, duszność, zmiany skórne, pokrzywka.
- objawy infekcji pasożytniczych: bóle brzucha, biegunka, utrata masy ciała, osłabienie, męczliwość.
- objawy ogólnoustrojowe – mogą być związane chorobami nowotworowymi – gorączka, osłabienie, powiększenie węzłów chłonnych, utrata masy ciała.
Objawy zespołu hipereozynofilowego – HES
Zespół HES występuje częściej u mężczyzn niż u kobiet i charakteryzuje się następującymi objawami:
- brak apetytu, utrata masy ciała, gorączka, nocne poty,
- problemy skórne – świąd skóry, wysypka grudkowo-plamista, pokrzywka, cellulitis (zapalenie tkanki łącznej obejmujące skórę i tkankę podskórną),
- choroby serca – kardiomiopatia,
- problemy ze strony układu nerwowego – zaburzenia czucia, zapalenia nerwów, eozynofilowe zapalenie opon mózgowo-rdzeniowych,
- ze strony płuc – nacieki płucne, guzki, ostra niewydolność oddechowa.
- problemy ze strony przewodu pokarmowego – zapalenie błony śluzowej żołądka, stany zapalne jelit, powiększona wątroba i/lub śledziona,
- incydenty zatorowo-zakrzepowe.
>> Przeczytaj też: Choroby skóry u człowieka. Najczęściej występujące dermatozy
Wysokie eozynofile – diagnostyka
W przypadku stwierdzenia wysokiego poziomu eozynofilii w morfologii wskazana jest pogłębiona diagnostyka.
Podniesione eozynofile i wywiad lekarski
Podwyższony poziom eozynofili może mieć źródła w wielu stanach klinicznych, dlatego, aby ukierunkować diagnozę, ważny jest wywiad lekarski i istniejące objawy.
Podwyższone eozynofile i bóle brzucha mogą świadczyć o infekcji pasożytniczej, dlatego w tym przypadku lekarz prawdopodobnie zleci dodatkowe badania parazytologiczne:
- kał na obecność pasożytów,
- badania przeciwciał w kierunku pasożytów.
Dokładny wywiad będzie obejmował nie tylko istniejące objawy, ale także ekspozycję na alergeny, podróże, przyjmowane leki, choroby współistniejące.
>> Może Cię zainteresować: Badanie kału w kierunku pasożytów. Jak się przygotować, ile trwa, co wykrywa? Fakty i mity

Podniesione eozynofile – dodatkowe badania
W zależności od zgłaszanych przez pacjenta objawów lekarz może zalecić:
- badania w kierunku pasożytów – kał na pasożyty, badania serologiczne krwi,
- IgE całkowite,
- IgE swoiste przeciwko wyselekcjonowanym alergenom,
- markery stanu zapalnego – CRP, OB,
- markery chorób autoimmunologicznych (przeciwciała ANA, ANCA, itp.),
- wymaz z nosa – eozynofilia diagnostyka alergicznego nieżytu nosa,
- badania obrazowe – RTG klatki piersiowej, USG jamy brzusznej, ECHO serca – w przypadku podejrzenia choroby serca,
- endoskopia,
- biopsja szpiku kostnego – w przypadku podejrzenia chorób mieloproliferacyjnych.

Eozynofilia – leczenie
Jak już wspomniano wyżej eozynofilia nie jest chorobą, lecz objawem, dlatego w leczeniu tego stanu jedynym możliwym rozwiązaniem jest leczenie choroby podstawowej. Czyli leki anythistaminowe w przypadku alergii. Leki przeciwpasożytnicze czy leki immunosupresyjne w przypadku chorób autoimmunologicznych. Leczenie choroby nowotworowej, jeśli to ona jest przyczyną eozynofilii.
Eozynofila – najczęściej zadawane pytania (FAQ)
Co to znaczy, że mam „podwyższone eozynofile” (eozynofilia)?
Eozynofilia to stan, w którym liczba eozynofili we krwi obwodowej jest wyższa niż norma. Podwyższone eozynofile nie są chorobą samą w sobie, lecz sygnałem, że w organizmie przebiega jakiś proces chorobowy, który wymaga pogłębionej diagnostyki.
Czy podwyższone eozynofile zawsze oznaczają coś poważnego?
Nie zawsze. Często są one wynikiem łagodnych i dobrze kontrolowanych alergii sezonowych. Jednakże mogą wskazywać na poważniejsze stany, takie jak infekcje pasożytnicze, choroby autoimmunologiczne czy nawet niektóre nowotwory.
O czym świadczą podwyższone eozynofile reszta w normie?
Podwyższony poziom eozynofili może świadczyć o alergii, infekcji pasożytniczej, chorobach autoimmunologicznych.
Czy eozynofilia może być dziedziczna?
Eozynofilia nie jest dziedziczna, ale skłonność do niektórych chorób, które ją powodują (np. alergie), może być genetycznie uwarunkowana.
Do jakiego lekarza należy się zgłosić z podwyższonymi eozynofilami?
Pierwszym krokiem powinna być wizyta u lekarza rodzinnego, który po zebraniu wywiadu zleci badania dodatkowe. Jeśli będzie to możliwe zleci leczenie, lub skieruje do lekarza specjalisty, np. alergologa, hematologa, reumatologa, gastroenterologa.
O czym mogą świadczyć dwukrotnie podwyższone eozynofile?
Przyczyny eozynofilii mogą być różne, może to być alergia, infekcja pasożytnicza, choroby automimmunologiczne i inne. Dlatego w takim przypadku zawsze należy zgłosić się do lekarza, który zleci odpowiednie postępowanie.
PIŚMIENNICTWO
Dembińska-Kieć A., Naskalski J., Solnica B., Diagnostyka laboratoryjna z elementami biochemii klinicznej, wydanie IV, Urban&Partner Wrocław 2017.